что это такое, и как от них не пострадать
Долгожданная поездка на пляж для жителей Флориды может обернуться неприятными последствиями — местные спасатели сообщают о «морских вшах» в воде. Уже есть пострадавшие.
Первые симптомы поражения морскими вшами — сильный зуд и раздражение на коже. В серьезных случаях у купальщиков наблюдаются симптомы гриппа: лихорадка, головная боль, озноб, тошнота.
О морских вшах спасатели предупреждают, выставляя на пляжах фиолетовые флажки.
Итак, что же такое «морские вши»?Несмотря на название, сыпь вызывают, конечно же, не вши, а чрезвычайно маленькие личинки медуз или же морские анемоны — актинии. Термин «морские вши» стал популярен в 1950-х годах среди жителей Флориды, страдавших от зудящей сыпи после купания в океане.
А вот ученые — против такого названия, ведь оно может вызвать путаницу. Дело в том, что существует рыбный паразит — вот он и есть настоящая «морская вошь».
По словам представителей Департамента здравоохранения Флориды, активность «морских вшей» обычно регистрируется с марта по август.
Если говорить о личинках медуз, то они часто попадают в купальники. Вы не чувствуете, что вас ужалили (как при «укусе» взрослой медузы), пока не появятся сыпь и зуд. Особенно «детеныши» медуз любят волосы, так что особенно рискуют быть ужаленными купальщики с длинными волосами.
Что сделать, чтобы не получить раздражение кожи от «морских вшей»:
- Воздержитесь от плавания, если спасатели предупреждают о риске.
- Наносите солнцезащитный крем.
- Всегда принимайте душ сразу после купания в океане
- Регулярно стирайте купальник и сушите его на горячей сушилке
Если же вас уже покусали, примите какой-нибудь антигистаминный препарат, смажьте кожу гидрокортизоном. Симптомы обычно проходят сами по себе за пару дней, но, если вам вдруг станет хуже, немедленно обратитесь к врачу.
Напомним, Нью-Джерси «оккупировали» ядовитые медузы.
Не так страшна вошь, как ее малюют …
Конечно, слово это неприятное. Недаром грубоватую «вшивость» у нас заменили на интеллигентно-благозвучный «педикулёз». Хотя суть явления от этого не изменилась.
В этом году некоторые сахалинские обыватели были ошарашены тем, что кроме традиционных вшей имеются, оказывается, вши морские, которые обитают на лососёвых. Кто-то, услышав по радио, что где-то на материке якобы была обнаружена партия зараженной вшами рыбы, чуть ли не аппетит потерял: что же это такое творится, куда катимся!
Спешим успокоить. Во-первых, о том, какие специалисты работают в российских контролирующих органах, хорошо было рассказано в предыдущем номере «Рыбака Сахалина» – сделать из мухи слона они всегда готовы. Во-вторых, речь шла только об одной партии, а не обо всех лососевых Сахалина. Ну а, в-третьих, морская вошь, несмотря на пугающее и неприятное название, совсем не то, что привычная земная вошь, которую в летний период находят иногда в голове возвратившегося из детского лагеря ребенка.
Морская вошь – это вид маленьких веслоногих рачков, которые испокон веков паразитируют на коже лососевых. Они поражают кожные покровы рыбы и портят её товарный вид. Но не настолько, конечно, как укусы морского зверя. И всё! Больше никаких неприятностей тварь эта не доставляет. Зараженная морскими вшами рыба не опасна для здоровья человека. Морская вошь погибает при термической обработке рыбы. Кроме того, эти рачки легко смываются водой. Поэтому увидеть своими глазами морскую вошь потребителю практически невозможно, тем более что далеко не все особи лосося ею поражены. В любом случае, даже попав в пищу (что, вообще-то, невероятно) этот паразит, в отличие от гельминтов, имеющихся в каждой рыбе, не представляет угрозы для человека.
По большому счету, такая тема, как морские вши, не заслуживает столь большого внимания газеты. Если бы не одно обстоятельство. Услышав сообщение о том, что на материке обнаружена партия сахалинской рыбы с морскими вшами, некоторые поспешили связать данный факт с организацией речного промысла лосося: дескать, горбуша нахваталась этих гадов именно в реках, которые, по общепринятому мнению, особой чистотой не отличаются. Но противники рыбопромысловых участков на реках явно поспешили. Потому что мудрая природа предусмотрела механизм регулирования численности морской вши, которая не может жить в пресной воде. Она сразу погибает в реках, куда лосось заходит нереститься и где подрастают мальки. Как бы сильно ни был заражен морскими вшами гуляющий в море лосось, во время нереста он всё равно избавится от паразитов. Так что добытый в реке лосось, как это ни покажется странным, в этом отношении чище добытого в море.
Но противники рыбопромысловых участков на реках явно поспешили. Потому что мудрая природа предусмотрела механизм регулирования численности морской вши, которая не может жить в пресной воде. Она сразу погибает в реках, куда лосось заходит нереститься и где подрастают мальки. Как бы сильно ни был заражен морскими вшами гуляющий в море лосось, во время нереста он всё равно избавится от паразитов. Так что добытый в реке лосось, как это ни покажется странным, в этом отношении чище добытого в море.
В. ПЕТРОВ. Газета «Рыбак Сахалина» № 48 от 8 декабря 2011 г.
В Ванкувере в упаковке лосося найдена морская вошь
В минувшую пятницу Александра Мортон отправилась в супермаркет в Северном Ванкувере, чтобы купить кусочек свежего атлантического лосося, выращенного на ферме.
Как независимый биолог, она часто покупает этот товар, чтобы проверить местную рыбу на вирусы.
Каково же было ее удивление, когда в упаковке лосося она обнаружила живую морскую вошь.
Морская вошь: что это?
Морская вошь относится к подвиду эктопаразитов, тех, кто живет снаружи организма животного. Наиболее известны китовая и лососевая.
Они очень быстро размножаются, особенно в благоприятных условиях лососевых ферм. Налипая на рыбу, рачки начинают ее поедать, рыба погибает или становится непригодной к употреблению.
“Очень редко можно встретить морских вшей на рыночной рыбе. Это просто говорит о том, что, при чистке рыбы, вшей было очень много, и одному удалось зацепиться на филе», – объясняет Мортон.
В заявлении по электронной почте Loblaws сообщает, что связался со своим поставщиком, чтобы обсудить протоколы качества.
«Мы гордимся продуктами, которые мы предоставляем нашим клиентам, и хотя морские вши не вредны для человека, этого не должно было случиться. Мы проверили весь лосось на полке, и это, похоже, единичный случай», – говорит представитель компании.
Мортон не винит магазин.
«В случившемся нет вины магазина. Это всего лишь признак проблемы, которая происходит на побережье и у которой огромные последствия».
«На фермах паразиты и вирусы быстро размножаются, потому что рыба не может от них убежать, а хищников нет. Так что число морских вшей постоянно увеличивается».
Мортон уверена, решением является размещение ферм на суше.
Но Ассоциация производителей лосося BC говорит, что сделать это не так просто.
«Необходим большой участок земли, специальные резервуары с водой, также нужно электричество, чтобы искусственно воспроизводить условия океана», – говорит представитель Шон Холл.
Пока наземное лососевое хозяйство все еще находится на ранних стадиях, но в будущем оно станет основной частью деятельности в Британской Колумбии. Сейчас фермеры, выращивающие лосося, используют новейшие технологии для борьбы с морскими вшами и проводят ежемесячные проверки для предотвращения эпидемий.
«Лососевые вши» становятся неуязвимыми благодаря людям
Новое исследование норвежских ученых подтвердило роль ферм по выращиванию лосося в распространении устойчивости к химическим препаратам у «лососевых вшей» — распространенных паразитов этих рыб.
Лососевыми, или морскими вшами называют планктонных рачков вида Lepeophtheirus salmonis, относящихся к подклассу веслоногих ракообразных (Copepoda). Эти ракообразные поселяются на поверхности тела и на жабрах рыб и питаются их тканями и кровью. Обычно молодь лососей заражается этими паразитами, когда выходит из рек в море. Если на мальке поселится слишком много «лососевых вшей», он может погибнуть. У взрослых рыб эти паразиты вызывают появление обширных язв, что ослабляет лососей и делает их уязвимыми для различных инфекций. Для человека этот паразит не опасен.
Lepeophtheirus salmonis распространен в прибрежных морях как Атлантического, так и Тихого океанов. Например, по данным Института биологических проблем Севера (Магадан), на Сахалине в отдельные годы зараженность горбуши этим паразитом достигает 90–96 % и на рыбах обнаруживаются от 5 до 50 взрослых рачков. В реках северного побережья Охотского моря заражены были около 35–70 % кеты и 40–90 % горбуши.
В рыбоводческих хозяйствах, в частности в Норвегии, для борьбы с паразитическими рачками используют химические препараты. С конца 1990-х годов основным средством стал бензоат эмамектина, но в течение десятилетия среди
Исследователи из Норвежского университета науки и технологии в Олесунде, Бергенского университета, Норвежского института морских исследований, Норвежского института природных исследований и компании PatoGen AS использовали генетические маркеры для изучения того, как индустрия аквакультуры повлияла на «лососевых вшей», живущих в норвежских фьордах. Эта группа установила, какие генетические особенности рачков связаны с устойчивостью к органофосфатам и пиретроидам — двум типам веществ, использующихся для борьбы с ними на рыбоводных фермах.
Ученые определили долю устойчивых к химическим препаратам «лососевых вшей» у рыб из девяти регионов по всей Норвегии.
В последние годы в Норвегии разрабатывают новые методы борьбы с паразитами лососей. Например, они содержат лососей вместе с рыбами пинагорами (
Педикулез — Официальный сайт Администрации Санкт‑Петербурга
Педикулез – поражение кожи человека, которое вызвано паразитами – вшами.
Почему то большое количество людей думают, что вши – это болезнь прошлого, но на самом деле, и в современное время педикулез – довольно частое явление.
Многие из нас помнят «вшивые моменты» в своем детстве, когда родители и бабушки обрабатывали голову бензином и сверху одевали кульки, а потом долго и нудно выискивали оставшиеся вши и гниды в волосах. Но это в лучшем случае, ведь какой позор был, особенно для девочек, когда приходилось состригать все волосы, чтобы легче было избавиться от нестерпимых насекомых.
Чаще всего головными вшами заражаются дети, но переносят взрослые.
В местах проживания большого скопления людей, где процветает антисанитария, вшивость встречается практически всегда (асоциальные многодетные семьи, цыганские таборы, приюты для людей без определенного места жительства, села, где нет свободного доступа к воде для гигиенических процедур и так далее).
Часты вспышки педикулеза в организованных детских коллективах (летние детские лагеря, интернаты, приюты, детские сады, младшие классы школы, в том числе, отнесенные к элитным заведениям, и так далее). Но и закрытые взрослые коллективы также могут быть «завшивлены»: казармы военных, места лишения свободы, психиатрические лечебницы и так далее.
В больших городах БОМЖи особенно способствуют распространению всех видов паразитов, а «ночные бабочки» нередко являются источником лобковых вшей.
В истории очень много описано фактов эпидемии педикулеза, это достаточно древняя болезнь, еще Геродот (5 столетий до нашей эры) описывал необходимость бриться наголо людей высоких чинов, чтобы ни одна вошь не прицепилась.
Ученые считают, что вши живы с тех времен и до тех пор, пока на планете Земля живет человек.
Во многих классических литературных произведениях всего мира также описываются сцены, связанные со вшами (у М. Шолохова, Л. Толстого, В. Шекспира, А. Чехова, Н. Гоголя, А. Солженицына, Р. Артюра и многих других классиков).
И в Библии есть упоминание о вшах, когда Ирод умер, с него «…текли вши, как родник, который течет из земли…».
Особенно высоко голову вши поднимали во время войн, голодовок, природных катастроф. Но не так опасны были сами вши, как те инфекции, которые они переносили.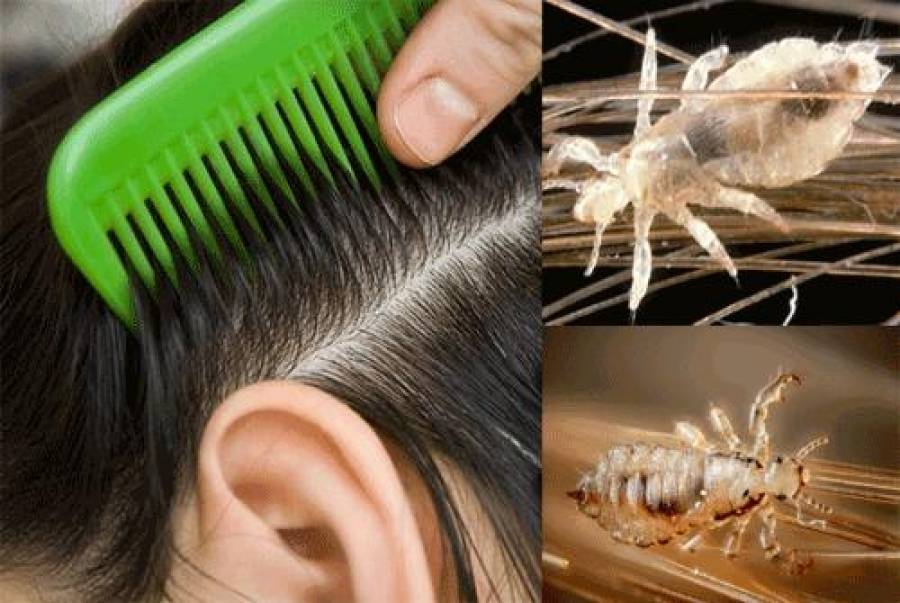
Способы передачи педикулеза
Источник заражения вшами – человек, на котором паразитируют вши, не зависимо от степени завшивленности.
Контактный путь – тесный контакт с человеком, страдающим педикулезом, при котором, вши переползают на волосы, тело или вещи здорового человека, возможно случайное (или специальное) струшивание паразитов со старого хозяина на нового. Головными вшами заразиться очень легко.
Передача через предметы ухода: полотенца, расчески, мочалки; заколки, резинки; нательные вещи, шапки (в том числе и капюшоны), шарфы; подушки, матрацы и другие. После использования предметов быта больными педикулезом людьми, могут некоторое время сохранять на себе вши, которые при тесном контакте переползают на нового хозяина. В предметах и вещах также могут созревать гниды, которые со временем превращаются во взрослые особи. Чаще всего через нательные вещи переносятся платяные вши, через головные уборы – головные, через нижнее белье – лобковые.
В предметах и вещах также могут созревать гниды, которые со временем превращаются во взрослые особи. Чаще всего через нательные вещи переносятся платяные вши, через головные уборы – головные, через нижнее белье – лобковые.
Половой путь передачи – основной путь заражения лобковыми вшами. При тесном контакте лобковых областей, площицы переползают на нового хозяина
Через воду – в местах массового купания людей (пляжи рек, озер, моря, бассейны). В воде вши могут прожить около 2-х суток, поэтому при купании вполне возможно попадание вшей на нового хозяина. Также вши могут переползти из песка, на пляже, из песочницы.
После попадания на нового хозяина вши перебираются на излюбленные легкодоступные места для паразитирования. В зависимости от стадии своего жизненного цикла (личинка или имаго), сразу или после созревания, начинают откладывать гниды и размножаться. Каждая взрослая особь ежедневно откладывает яйца на протяжении всей жизни: головная вошь – до 4 штук в сутки, платяная – до 16 штук, лобковая – до 3 штук.
Каждая самка вши плодит за время своего взрослого существования от нескольких десятков до двух сотен потомков. Так, «оседлая» нового хозяина, вши быстро готовы распространяться и на других.
Наиболее быстро головные и платяные вши распространяются в местах большого скопления людей (детские коллективы, общественный транспорт, общежития, коммуны, казармы, тюрьмы и так далее). А также в местах с антисанитарными условиями, где не ухаживают за телом, вещами и предметами ухода (места обитания БОМЖей, асоциальные семьи, места лишения свободы, приюты, места, где нет свободного доступа к воде).
Наиболее быстро распространяются человеческие вши (головные и платяные).
В местах, где педикулез был выявлен хотя бы у одного человека, называют эпидемическим очагом.
Эпидемия педикулеза – это распространение педикулеза, которое превышает в несколько раз заболеваемость, характерную для определенного региона и времени года. Эпидемический порог педикулеза для каждого региона или страны разный.
Эпидемический порог педикулеза для каждого региона или страны разный.
Почему дети часто болеют головным педикулезом? Дети ежедневно находятся в контакте с другими детьми, при этом, во время игр они не соблюдают дистанцию по отношению друг к другу. Также могут путать свои предметы личной гигиены или вещи с чужими, спят на подушках друг друга, вши также могут остаться на игрушках (особенно мягких).
Лечение педикулеза
Лечение любого вида педикулеза должно быть тщательным и комплексным.
Лечебные мероприятия включают в себя:
— медикаментозное лечение,
— личная гигиена,
— обработка вещей, постельного белья, предметов обихода и помещений,
— профилактика повторной заболеваемости.
Санитарная обработка «вшивости», особенно при распространенном процессе, платяном педикулезе, лучше проводить в специальных учреждениях, под контролем эпидемиологов санитарно-эпидемической службы. Но, в большинстве случаев, успешно вывести вшей можно и в домашних условиях.
Но, в большинстве случаев, успешно вывести вшей можно и в домашних условиях.
Важно! Применение старых народных методов, таких, как керосин и уксус – малоэффективны, не убивают гниды, и могут нанести вред коже, особенно детской (химический ожог, аллергия, выраженная сухость кожи), привести к острому отравлению с поражением печени и почек, а также могут спровоцировать развитие бронхообструктивного синдрома (сужение бронхов, характерное при бронхиальной астме).
паразитирующие представители ракообразных на китах и лососе
Представители животного мира окружены целым полчищем насекомых, которые паразитируют практически на всех обитателях планеты. Морская вошь относятся к подвиду эктопаразитов, тех, кто живет снаружи организма животного. Наиболее известны китовая и лососевая.
С точки зрения разведения рыб в прудах (аквакультуры), наиболее опасными представляются пресноводные паразиты.
Морская паразитофауна разнообразна, как и жители морей. Есть сосальщики-тунеядцы, которым не нужен определенный вид морских животных, есть те, кто предпочитает только одного «хозяина». Только двух таких морских рачков называют вшами.
Есть сосальщики-тунеядцы, которым не нужен определенный вид морских животных, есть те, кто предпочитает только одного «хозяина». Только двух таких морских рачков называют вшами.
Морская вошь, паразитирующая на китах
Китовая вошь (Cyamidae) представляет собой ракообразное существо из отряда бокоплавов.
Это довольно большое существо размером от десяти до двенадцати миллиметров, которое ведет паразитарный образ жизни, прикрепляясь к коже китов (с особым удовольствием в районе анального и полового отверстий) и питаясь их кровью. Язвы от укусов могут быть достаточно большими и болезненными.
Лососевая вошь
Lepeophtheirus salmonis — лепеофтеирус сальмонис — ракообразное существо, которое относится к подклассу веслоногих (копепод), входит в отряд Siphonostomatoida. Живет только в морской воде. Прикрепившись к диким видам лосося в океане, отпадает от тела хозяина, как только рыба входит в пресноводную зону на нерест.
Численность лепеофтеируса сальмонис в морских водах регулируется естественным образом, как и все в природе. Опасность для рыб этот паразит представляет на стыке искусственного разведения лосося в морской воде и прохождения мимо диких рыб.
Опасность для рыб этот паразит представляет на стыке искусственного разведения лосося в морской воде и прохождения мимо диких рыб.
Нерестится лосось в пресной воде, затем мальки выбираются в морскую, там откармливаются, взрослеют, жиреют, затем идут обратно к месту рождения в пресноводные реки.
При искусственном разведении участки с морской водой, находящиеся в собственности у фермерских хозяйств, располагаются, как правило, в тех водах, где может расти лосось, или там, где он проходит к пресной воде.
Морским вшам, фото которых на рыбах достаточно многочисленны, все равно, на ком паразитировать, но предпочтение отдается, естественно, самым уязвимым с точки зрения прокуса кожи — малькам. И если размер тела копепода в случае большой особи не имеет значения, то мальки очень уязвимы.
А если учесть, что в «садках», где откармливаться должны лососевые в течение двух лет, рыбы живут почти вплотную друг к другу, то от ослабленного иммунитета, на фоне которого возникают всяческие вирусные заболевания, гибнет до восьмидесяти процентов поголовья (по данным норвежских и британских компаний, статистика российских хозяйств неизвестна — то ли ввиду их малочисленности, то ли просто замалчивается).
Самое плохое заключается в том, что избавиться на сто процентов от этой напасти — морских вшей лососевых рыб — невозможно. Остается надеяться на меры профилактики.
Как убить лососевых морских вшей?
Ученые, занимающиеся паразитофауной рыб, считают самым успешным способом простое уничтожение зараженных рыб методом сжигания. Это очень дорогостоящий метод. Естественно, что все рыбоводческие хозяйства не закладывают в бюджет такие расходы. Когда доходы только от продаж, взять кредит на уничтожение рыб не получится. Это не может позволить никакой коммерческий банк. В такой ситуации хозяйствам легче оставить зараженные садки в покое, надеясь, что вши сами уничтожатся. И тогда становится понятно, почему в северных морях морская вошь лососевых все больше размножается.
Многие зарубежные фирмы сразу выявляют заражение рыб, когда еще в садках всего несколько таких особей. Это служит сигналом к лечению рыб антибиотиками, пестицидами, иногда даже в садки могут быть подсажены рыбы, питающиеся лепеофтеирусом сальмонис, рода Ballan Wrasse. Конечно, принимаются все меры к отлову зараженных рыб, но паразиты размножаются с огромной скоростью.
Конечно, принимаются все меры к отлову зараженных рыб, но паразиты размножаются с огромной скоростью.
Чем опасно заражение рыб паразитами лепеофтеирусом сальмонис
В диком виде промысел лососевых не обходится без поимки рыб с паразитами. Естественно, сразу возникает вопрос о том, насколько морские вши опасны для человека и что делать, если паразит переползет.
Работники промысловых судов, занятые обработкой рыбы, знают, что в неродной среде (на воздухе или в пресной) морские вши не живут, не кусают человека, не переносят никаких заболеваний.
Сама рыба от укусов теряет свой товарный вид. При промывке ее пресной водой паразиты смываются, а при термической обработке не теряется даже товарность.
Обнаружение в баночках рачков-паразитов этого вида — непредсказуемая случайность. Хотя для брезгливых — это повод выбросить весь продукт, но икра, даже при наличии посторонних примесей не перестает быть полезной и вкусной. Хотя, конечно, хотелось бы приобретать этот продукт без них.
Морская вошь и большая политика
Как «Русский лосось» попал под карантинНа фермах компании «Русский лосось» в Лиинахамари под Мурманском увольняют работников, а на самих участках, где разводят рыбу, бушуют всевозможные рыбьи болезни, переносчиком которых является морская вошь. Что происходит на предприятии и в чем причина бедственного положения одного из флагманов российской аквакультуры?
Тревожные сообщения о ситуации на объектах «Русского лосося» в Баренцевом море распространяются в блогах и социальных сетях. Администрация предлагает работникам увольняться по собственному желанию, а в случае несогласия в ход идут увольнения по инициативе администрации по надуманным причинам. Рассказывают, что без зарплаты сидят и норвежские ветеринары. Причиной увольнений, говорят очевидцы, стали финансовые затруднения компании, а также эпидемия, которая поразила большую часть рыбных садков.
Наибольшее количество участков «Русского лосося» располагается в районе Печенгской губы.
 Там базируется 50 садков, в которых, как стало известно, завелся достаточно распространенный паразит – разносчик вирусов, известный под названием морская вошь. Большое количество уже больной и погибшей рыбы подлежит уничтожению во избежание дальнейшего распространения инфекции. Единственное, почему этого до сих пор не сделано – надежда на «русский авось» и доверительные отношения руководства компании с администрацией Мурманской области и губернатором Мариной Ковтун.
Там базируется 50 садков, в которых, как стало известно, завелся достаточно распространенный паразит – разносчик вирусов, известный под названием морская вошь. Большое количество уже больной и погибшей рыбы подлежит уничтожению во избежание дальнейшего распространения инфекции. Единственное, почему этого до сих пор не сделано – надежда на «русский авось» и доверительные отношения руководства компании с администрацией Мурманской области и губернатором Мариной Ковтун. Не так давно губернатор лично хвалила «Русский лосось», говоря, что это прекрасный опыт ведения бизнеса, а администрация Мурманской области будет и дальше оказывать всяческую поддержку этой компании. Компания «Русский лосось», входящая в состав группы компаний «Балтийский берег», как сообщалось, планировала к 2015 году занять до 40% российского рынка лосося. Для этих целей «Русский лосось» в 2009 году приобрел три компании, которые занимались в акватории Баренцева моря разведением лосося, живорыбное судно «Лиинахамари» и более 130 садков.

Каждый садок размером 50 квадратных метров, а в нем 50-70 тысяч особей, которые выращиваются до двухлетнего возраста. Все, что в итоге производится «Русским лососем», отправляется в «Балтийский берег» и сбывается на рынке уже этой компанией. Теперь, и амбициозным планам «Русского лосося», и бизнесу «Балтийского берега» угрожает банальная морская вошь.
Как известно, морские вши водятся преимущественно на красной рыбе, в том числе на лососях и форели. Быстрое распространение вшей на фермах связано с тем, что большое количество рыбы находится очень близко друг к другу. Этот паразит поражает кожные покровы. По данным научного журнала «Proceedings of the Royal Society B», гибнет около 55% зараженной рыбы. Причем опасность вши представляет не только для той рыбы, что выращивается на фермах, но и для дикого лосося, который может проходить мимо них, а затем разносить вшей среди своих «собратьев». При этом преимущественно поражается молодь.
Существует несколько способов борьбы со вшами.
 Степень их радикальности сильно разнится: от кормления рыбы антибиотиками и пестицидами до разведения в районах развитой аквакультуры рыбок вида Ballan Wrasse, которые питаются вшами. Но ни один из них не является «панацеей» — все способы затратны, а подчас несут риски для самих потребителей.
Степень их радикальности сильно разнится: от кормления рыбы антибиотиками и пестицидами до разведения в районах развитой аквакультуры рыбок вида Ballan Wrasse, которые питаются вшами. Но ни один из них не является «панацеей» — все способы затратны, а подчас несут риски для самих потребителей. Инфекция представляет опасность не только для Печенгской губы, но и для всей акватории Баренцева моря. Но вместо того, чтобы обеспечить локализацию очага инфекции и применить хоть какие-то меры к прекращению распространения заразы, ЗАО «Русский лосось» пытается умолчать о проблеме, о которой, впрочем, уже известно и властям, и экологам, о чем также пишут местные жители в социальных сетях.
Заражение рыбы можно было прекратить в самом начале, если бы применить необходимые меры, но у компании нет денег, а банки не хотят давать кредиты под больную рыбу, которую следует сжигать, а на месте ее заражения вводить карантин и ждать пока участки очистятся. В итоге получается замкнутый круг: на предотвращение ситуации нужны деньги – денег нет, так как нет продаж.

Пытаясь хоть как-то спасти ситуацию, компания запускает новых мальков на еще не зараженные участки, однако зараза охватывает все новые и новые садки. То, что молчит рыба — понятно. Понятно и молчание сотрудников «Русского лосося», опасающихся увольнений. Но почему молчат власти и экологи – большой вопрос.
А причина, если внимательно присмотреться в том, что государство слишком мало внимания уделяет аквакультуре. Последние двадцать лет аквакультура в России росла, как сорная трава – без профильного закона, в отсутствии комплексной господдержки и нормативно-правовой базы, в условиях противодействия местных чиновников, лоббирующих интересы рыбодобытчиков. Плюс все проблемы, с которыми сталкивается малый и средний бизнес в нашей стране (а крупных компаний в этой отрасли практически нет). Отсюда и все неприятности, потенциальные или реальные, связанные и с отсутствием четких требований и контроля за их исполнением при выращивании рыбы.
Закон об аквакультуре должен изменить ситуацию в рыбной отрасли.
 Во всяком случае, на него возлагают большие надежды. И вот в марте, говорят источники в Госдуме, многострадальный закон может быть принят, а с его помощью в России смогут восстановить практически отсутствующее разведение и выращивание рыб, раков, моллюсков и прочих. Неизвестно, позволит ли закон избавить лосося от морских вшей, но ясно, что мариводы должны вздохнуть свободнее. Принятие закона обеспечит льготы для предприятий аквакультуры, понятные правила игры на рынке, а главное – позволит регламентировать деятельность компаний, занимающихся разведением рыбы, и защитить производителей от браконьеров и прочего произвола.
Во всяком случае, на него возлагают большие надежды. И вот в марте, говорят источники в Госдуме, многострадальный закон может быть принят, а с его помощью в России смогут восстановить практически отсутствующее разведение и выращивание рыб, раков, моллюсков и прочих. Неизвестно, позволит ли закон избавить лосося от морских вшей, но ясно, что мариводы должны вздохнуть свободнее. Принятие закона обеспечит льготы для предприятий аквакультуры, понятные правила игры на рынке, а главное – позволит регламентировать деятельность компаний, занимающихся разведением рыбы, и защитить производителей от браконьеров и прочего произвола.Posted on Feb. 19th, 2013 at 12:20 pm | Link | Leave a comment | 372 comments | Share | Flag
Жизненный цикл лососевой воши
Lepeophtheirus salmonis , лососевая вошь, встречается в холодных водах с умеренным климатом в северном полушарии. L. salmonis — эктопаразит, который встречается у всех видов лососевых; лосось, форель и голец. Их можно найти на других видах рыб в качестве временной меры при поиске хозяина из лососевых рыб.
Их можно найти на других видах рыб в качестве временной меры при поиске хозяина из лососевых рыб.
L. salmonis имеет прямой жизненный цикл (т.е. один хозяин) с восемью стадиями жизни (Hamre et al. 2013).Взрослая самка морской вши выдавливает пару яичных нитей, и стадии планктонных науплий вылупляются непосредственно в толщу воды. Продолжительность стадии яйца варьируется от 17,5 дней при 5 ° C до 5,5 дней при 15 ° C.
Науплиус Леп
Эти планктонные науплии не могут направленно плыть против течения воды, а пассивно дрейфуют и могут регулировать свою вертикальную глубину в толще воды. Они почти полупрозрачные по цвету и имеют длину около 0,5-0,6 мм.При 5 ° C стадия науплиуса 1 длится около 52 часов и около 9 часов при 15 ° C.
Nuaplius 2 работает при этих температурах 170 часов и 36 часов соответственно. Они чувствительны к свету и солености. Низкая соленость оказывает большее влияние на стадии планктона, чем на стадии паразита. Только что вылупившиеся личинки не выживают при солености ниже 15, а плохое развитие инфекционных копеподид происходит между 20 ‰ и 25. Науплии и копеподиды обладают положительной фототактикой и демонстрируют ежедневную вертикальную миграцию, поднимаясь днем и опускаясь ночью.Способность найти своего хозяина не зависит от света. Было показано, что они реагируют на низкочастотные ускорения в воде, например, производимые плавающей рыбой. Найти своего мигрирующего хозяина на просторах океана все еще остается загадкой для ученых, но этому виду удавалось эффективно делать это на протяжении тысячелетий.
Науплии и копеподиды обладают положительной фототактикой и демонстрируют ежедневную вертикальную миграцию, поднимаясь днем и опускаясь ночью.Способность найти своего хозяина не зависит от света. Было показано, что они реагируют на низкочастотные ускорения в воде, например, производимые плавающей рыбой. Найти своего мигрирующего хозяина на просторах океана все еще остается загадкой для ученых, но этому виду удавалось эффективно делать это на протяжении тысячелетий.
Жизненный цикл
L. salmonisЭти свободно плавающие науплии затем переходят в инфекционную стадию копеподид, что может занять от 2 до 14 дней в зависимости от температуры воды.Планктонные стадии должны жить за счет своих жировых запасов, они не могут питаться, пока не найдут хозяина и не линяют до стадии паразитического халимуса.
Первоначальное прикрепление копеподид обычно происходит на плавниках рыб или чешуе. Копеподиды сжимают ткань хозяина, затем подвергаются линьке до первой сидячей стадии жизненного цикла. Оседание и выживаемость копеподид через 10 дней после заражения значительно выше при 12 ° C, чем при 7 ° C. Размер веслоногих составляет около 0,7-0.8мм. Эта следующая стадия называется халимусом, который прикрепляется с помощью лобной нити (проникающей нити), которая прокалывает эпидермис хозяина.
Копеподиды сжимают ткань хозяина, затем подвергаются линьке до первой сидячей стадии жизненного цикла. Оседание и выживаемость копеподид через 10 дней после заражения значительно выше при 12 ° C, чем при 7 ° C. Размер веслоногих составляет около 0,7-0.8мм. Эта следующая стадия называется халимусом, который прикрепляется с помощью лобной нити (проникающей нити), которая прокалывает эпидермис хозяина.
Халимус Леп
Стадии халимуса линяют через две стадии, которые прикрепляются к рыбе, прежде чем они становятся пре-взрослыми или подвижными стадиями, а затем могут перемещаться по поверхности рыбы, а также могут плавать в толще воды.
Продолжительность составляет приблизительно 10 дней для копеподид, ~ 10 дней для халимуса I, ~ 15 для халимуса 2, ~ 10 дней для 1 самки до взросления и ~ 12 дней для 2 самок до взрослого при 10 ° C.Самцы развиваются быстрее, проводя ~ 8 дней в первом возрасте до взрослого и ~ 9 дней в возрасте до взрослого 2 при температуре 10 ° C. Ступени халимуса имеют длину от c 1,1 мм на стадии 1 до c 2,3 мм на стадии 2.
Ступени халимуса имеют длину от c 1,1 мм на стадии 1 до c 2,3 мм на стадии 2.
Взрослый Леп, до взрослого 1 и до взрослого 2
За двумя предварительными взрослыми стадиями следует фаза полностью зрелого имаго. В до-взрослом возрасте генитальный комплекс недоразвит, и его средняя длина составляет около 3,6 мм. Затем происходит финальная линька до взрослых стадий, как мужских, так и женских. Самка крупнее самца, самцы имеют размер 5-6 мм, а самки 8-18 мм.Взрослая самка L. salmonis может произвести от десяти до одиннадцати пар яичных нитей в течение своего жизненного цикла. Среднее количество яиц на цепочку (плодовитость) было зарегистрировано как 152 (+16) с диапазоном от 123 до 183 при 7,2 ° C Heuch et al. 2000.
Развитие половой зрелости после прикрепления к рыбе-хозяину зависит от температуры воды и времени генерации, от яйца до взрослой особи, и колеблется от 32 дней при 15 ° C до 106 дней при 7,5 ° C. Яичные нити, как правило, длиннее, плодовитость выше при более низких температурах, но факторы, влияющие на яйценоскость, недостаточно изучены.
Время образования морских вшей составляет около 8-9 недель при 6 ° C, 6 недель при 9 ° C и 4 недели при 18 ° C. Продолжительность жизни взрослой особи в естественных условиях не определена, но в лабораторных условиях самки живут до 210 дней.
Список литературы
Hamre LA, Eichner C, Caipang CMA, Dalvin ST, Bron JE, et al. (2013) Лососевая вошь Lepeophtheirus salmonis (Copepoda: Caligidae) Жизненный цикл имеет только две стадии халимуса. PLoS ONE 8 (9): e73539.DOI: 10.1371 / journal.pone.0073539
Heuch P.A., Nordhagen J.R., Schram T.A. (2000) Производство яиц лососевой вошей [ Lepeophtheirus salmonis (Krøyer)] в зависимости от происхождения и температуры воды. Исследования аквакультуры 2000; 31: 805-814. DOI: 10.1046 / j.1365-2109.2000.00512.x
Schram TA (1993) Дополнительные описания стадий развития Lepeophtheirus salmonis (Krøyer, 1837) (Copepoda: Caligidae). В: GA BoxshallD. Defaye. Возбудители диких и выращиваемых рыб: морские вши. Нью-Йорк: Эллис Хорвуд. стр. 30-47
Нью-Йорк: Эллис Хорвуд. стр. 30-47
Немедикаментозные подходы к борьбе с морскими вшами
Отрасль разведения лосося постоянно ищет новые подходы и эффективные методы для улучшения борьбы с морскими вшами, включая как лекарственные, так и немедицинские подходы.
Поскольку промышленность стремится расширить использование немедицинских подходов там, где это целесообразно, разрабатывается и внедряется ряд новых подходов, которые описаны ниже.Поскольку отрасль ищет постоянных инноваций, многие из них все еще находятся на стадии разработки или исследования, но есть надежда, что со временем их можно будет использовать более широко.
Общие немедикаментозные подходы, используемые на фермах
Юбки от морских вшей
Юбки — это листы материала (обычно брезент), которые крепятся вокруг верхней части загона для лосося. Поскольку личинки морских вшей обычно находятся на первых нескольких метрах воды ниже поверхности, юбка может действовать как щит, предотвращая попадание морских вшей в верхней части воды на лососевую ферму. Чтобы избежать нежелательного воздействия на уровень кислорода в воде в верхней части ручки, при использовании юбок учитывается управление кислородом.
Чтобы избежать нежелательного воздействия на уровень кислорода в воде в верхней части ручки, при использовании юбок учитывается управление кислородом.
Функциональный корм против морских вшей
Функциональные корма — это специально разработанные корма, которые поддерживают оптимальное здоровье рыб. При использовании для борьбы с морскими вшами они специально созданы для того, чтобы содержать определенные ингредиенты, которые помогают лососю бороться с морскими вшами двумя ключевыми способами:
1.Поддержка естественной защиты рыб:
- Укрепление внешних барьеров для рыб за счет утолщения защитных слоев слизи на коже
- Повышение иммунной и воспалительной реакции рыб
2. Воздействие на морских вшей
- Изменение развития / роста морских вшей
- Снижение способности морских вшей прикрепляться к рыбе
- Снижение подавления иммунитета, вызванного морскими вшами
GSI тесно сотрудничает со своими ассоциированными членами BioMar, Cargill и Skretting, чтобы делиться знаниями и передовым опытом об использовании функциональных кормов и их роли в борьбе с морскими вшами. Кроме того, члены GSI работают с компаниями по производству кормов для постоянного мониторинга эффективности функциональных кормов с целью стимулирования прогресса в исследованиях и разработках этих кормов.
Кроме того, члены GSI работают с компаниями по производству кормов для постоянного мониторинга эффективности функциональных кормов с целью стимулирования прогресса в исследованиях и разработках этих кормов.
Шноркели
Трубки создают барьер между лососем и морскими вшами. Крыша из сетки помещается в загон для лосося с закрытой трубкой (или трубкой) наверху, доходящей до поверхности воды.Эта технология удерживает лосося глубже в толще воды и, следовательно, от личинок морских вшей, которые, как правило, встречаются на первых нескольких метрах воды.
Поскольку лососям необходимо достичь поверхности, чтобы набрать воздух в свои плавательные пузыри, конструкция трубки для снорклинга позволяет рыбе легко достигать поверхности в защищенной зоне, которая отделяет их от морских вшей.
Термические процедуры (т.е. Термоаппарат / Optilicer)
Морские вши плохо переносят резкие перепады температуры воды, и эта чувствительность используется при термической обработке. Система термообработки устанавливается на лодке или барже рядом с загоном для лосося, и рыба ненадолго пропускается через систему и купается в теплой воде. Это изменение температуры убивает морских вшей, и лосось возвращается обратно в загон.
Система термообработки устанавливается на лодке или барже рядом с загоном для лосося, и рыба ненадолго пропускается через систему и купается в теплой воде. Это изменение температуры убивает морских вшей, и лосось возвращается обратно в загон.
Процесс термической обработки:
- Рыба попадает в систему
- Отделение воды
- Морская вода фильтруется и выпускается
- Рыба проходит через более теплую воду
- Лечебная петля
- Водная поверхность
- Водоотделитель для очистки воды
- Рыба выходит из системы
- Нагретая вода подается в резервуар для воды для фильтрации, аэрации и повторного нагрева
- Вода для очистки перекачивается обратно в систему для повторного использования
Стратегическая локализация и обработка сайтов
Изучая потоки океанской воды и течения, можно предсказать, как будут распространяться морские вши — например, различия в солености воды между регионами и фермами могут иметь значительное влияние на уровень вшей и управление ими. Используя эту информацию, можно стратегически разместить фермы в тех районах, где с меньшей вероятностью обитают морские вши. Кроме того, этот подход можно использовать для информирования о стратегии лечения загонов, обеспечивая приоритетность лечения именно в таких загонах.
Используя эту информацию, можно стратегически разместить фермы в тех районах, где с меньшей вероятностью обитают морские вши. Кроме того, этот подход можно использовать для информирования о стратегии лечения загонов, обеспечивая приоритетность лечения именно в таких загонах.
Промывочные устройства (например, Hydrolicer, Flatsetsund Flusher)
Морских вшей можно вытеснить струей воды (как душ).Этим воспользовались, пропуская лосося через систему водяных струй, чтобы смыть вшей. Система смыва устанавливается на лодке или барже рядом с загонами для лосося, и рыба ненадолго пропускается через устройство для смыва. Отделившихся вшей собирают, а затем лосося возвращают в загон.
Лазеры
Камера и лазерная система, помещенные в переноски для рыб, для обнаружения морских вшей на лососях, и при обнаружении вошей лазерный импульс воздействует непосредственно на конкретную вошь.Вшей поражают и убивают лазером, удаляя вошь из лосося. Система работает внутри пера 24/7.
Система работает внутри пера 24/7.
Кожа лосося похожа на зеркало, поэтому сам лосось не пострадает, так как кожа отражает лазерный луч.
Ловушки для морских вшей
Этот метод похож на ловушку для ос. Размещая ловушки в воде вокруг лососевых ферм, они привлекают вшей из загонов в ловушки, тем самым удаляя их.Чтобы привлечь как можно больше морских вшей, в некоторых ловушках есть мигающие огни, которые, как было установлено, привлекают морских вшей.
Очиститель рыбы
Есть несколько видов рыб, включая баллан-губана и пинагора, которые естественным образом питаются морскими вшами. Этих рыб вводят в загоны для лосося, чтобы они съели морских вшей с лосося. Это биологический подход к борьбе с морскими вшами, и в настоящее время ведутся исследовательские проекты по выявлению более потенциально более чистых видов рыб.
Глубокое освещение / Глубокое кормление
Размещая источники света или системы кормления глубоко в загоне (~ 10 метров от поверхности), лосося привлекают плавать и кормиться в более глубокой воде загона. Поскольку морские вши обычно остаются в поверхностных водах, эти подходы уводят лосося от морских вшей.
Поскольку морские вши обычно остаются в поверхностных водах, эти подходы уводят лосося от морских вшей.
Пузырьковые шторы
Устройство помещается вокруг нижней части загона для лосося и выпускает линию пузырьков воздуха, которые поднимаются от дна к поверхности загона.Пузырьки воздуха создают барьер или стену, и морские вши не могут проникнуть в загон для лосося.
h3O2 (перекись водорода)
Известно, чтоh302 временно парализует морских вшей, заставляя их падать с лосося и уменьшая их способность к повторному прикреплению. Лосось временно подвергается воздействию h3O2 — либо в лодке с колодцем, либо в специально разработанном брезенте, куда добавляется h3O2.После этого морская вода пропускается через загон, чтобы разбавить h3O2, быстро разлагая его на воду и кислород.
h3O2 является зарегистрированным лекарством, то есть его использование регистрируется и контролируется. Однако, поскольку h3O2 разжижается до воды и кислорода, он имеет нулевую токсичность и нулевую стойкость в окружающей среде и поэтому считается немедикаментозным подходом к борьбе с морскими вшами.
Отчет Министерства здравоохранения Канады
Канадский научный консультативный отчет
Mowi
Заявление на получение разрешения на использование пестицидов Грига
Новые подходы к борьбе с морскими вшами, которые в настоящее время разрабатываются / исследуются
УЗИ
Ультразвук используется под водой в загонах для лосося с определенной частотой, которая вытесняет и убивает морских вшей, не беспокоя лосося.Частота установлена на низком уровне, чтобы не воздействовать на окружающих рыб или морских млекопитающих.
Вакуум
Для очистки сетей загонов для лосося используется вакуумная система, которая не только удаляет грязь и мусор, но и удаляет морских вшей из сети.
Очистка пресной воды
Морские вши чувствительны к пресной воде (т.е. не морская вода) и, как правило, не может выжить при очень низкой солености воды. Пресноводные методы используют это, и, временно подвергая лосося воздействию пресной воды, морские вши отделяются и могут быть удалены.
В дикой природе лосось мигрирует в пресную воду для нереста, и эта подмена воды устраняет всех морских вшей. Чтобы морские вши не развили устойчивость к пресной воде и не нарушили этот естественный процесс, использование этого процесса тщательно контролируется и регулируется.
Морские вши, Lepeophtheirus salmonis (Krøyer 1837), зараженный атлантический лосось (Salmo salar L.) более восприимчивы к вирусу инфекционной анемии лосося.
Образец цитирования: Barker SE, Bricknell IR, Covello J, Purcell S, Fast MD, Wolters W., et al. (2019) Морские вши, Lepeophtheirus salmonis (Krøyer 1837), инфицированный атлантический лосось ( Salmo salar L.) более восприимчивы к вирусу инфекционной анемии лосося. PLoS ONE 14 (1): e0209178. https://doi.org/10.1371/journal.pone.0209178
Редактор: Масами Фудзивара, Техасский университет A&M, США
Поступила: 20 апреля 2018 г . ; Одобрена: 2 декабря 2018 г .; Опубликовано: 16 января 2019 г.
; Одобрена: 2 декабря 2018 г .; Опубликовано: 16 января 2019 г.
Это статья в открытом доступе, свободная от всех авторских прав, и ее можно свободно воспроизводить, распространять, передавать, изменять, строить или иным образом использовать в любых законных целях.Работа сделана доступной по лицензии Creative Commons CC0 как общественное достояние.
Доступность данных: Все соответствующие данные находятся в документе и его файлах с вспомогательной информацией.
Финансирование: Авторы хотели бы поблагодарить Северо-Восточный региональный центр аквакультуры за награду № 2010-38580-21074, https://www.ncrac.org, и Экспериментальную станцию сельского и лесного хозяйства штата Мэн (США), https: //umaine.edu/mafes/, NIFA MAFES за награду № ME21501 за поддержку этой работы.Финансирующие организации не играли никакой роли в дизайне исследования, сборе и анализе данных, принятии решения о публикации или подготовке рукописи.
Конкурирующие интересы: Авторы заявили, что конкурирующих интересов не существует.
Введение
Лососевая вошь, Lepeophtheirus salmonis (Krøyer 1837) и вирус инфекционной анемии лосося (ISAv) являются двумя наиболее значительными патогенами индустрии аквакультуры атлантического лосося ( Salmo salar , L). Л . salmonis имеет серьезные экономические последствия для отрасли, и, по оценкам, убытки во всем мире варьируются от примерно 500 миллионов долларов США до примерно 1 миллиарда долларов США [1–5].
Морские вши имеют сложный жизненный цикл, состоящий из трех планктонных стадий: науплиус I и науплиус II, за которыми следует стадия поиска хозяина копеподид. После прикрепления стадии копеподид паразит линяет на прикрепленный халимус I и II стадии, где он питается эпидермисом рыбы.За этим следует линька в подвижную предзрелую стадию I, а затем в предзрелую стадию II, прежде чем, наконец, линька до стадии половозрелой взрослой особи. Жизненный цикл зависит от температуры и может длиться от 28 дней при 14 ° C до нескольких месяцев при более низких температурах.
Жизненный цикл зависит от температуры и может длиться от 28 дней при 14 ° C до нескольких месяцев при более низких температурах.
Планктонные стадии причиняют мало вреда хозяину, хотя было высказано предположение, что копеподиды съедают небольшую порцию пищи, прежде чем прикрепятся к хозяину [6]. Две стадии сидячих халимусов причиняют лишь незначительное повреждение хозяину, и повреждение ограничивается эпидермисом.Повреждение вызывается выдавливанием и прикреплением лобной нити и местной эрозией ткани, поскольку паразит питается связанным эпителием. Что еще более важно, имеются значительные доказательства того, что прикрепленные стадии халимуса подавляют иммунный ответ хозяина, что может повышать восприимчивость к другим патогенам и вторичным инфекциям, особенно в месте прикрепления [7, 8].
Предварительно взрослая и взрослая стадии подвижны и могут довольно легко перемещаться между хозяевами.Вшей до взрослого возраста ловили в дозорных садках с атлантическим лососем в Норвегии, Ирландии, Канаде и Шотландии [9–12]. Работа Pino-Marambio et al, Mordue и Birkett [13, 14] показала, что взрослые и недовозрастные особи будут повторно сортировать себя по рыбе в зависимости от наличия потенциальных партнеров, причем самцы в этом отношении гораздо более подвижны, чем самки. Была проведена некоторая работа по изучению морских вшей как переносчиков болезней, включая вирус инфекционного гематопоэтического некроза (IHNv), [8], вирус инфекционной анемии лосося (ISAv, [15]) и фурункулез [16].Эти исследования были сосредоточены на обнаружении присутствия патогена на взрослых морских вшах или внутри них, а не на полном исследовании передачи. [15,16] Основные патологические эффекты возникают в результате подвижных стадий, которые могут поглощать большое количество эпителиальной ткани, образуя большие поражения, через которые может проникнуть вторичная инфекция. Возможно, если подвижные стадии питаются рыбой, которая уже инфицирована патогеном, тогда она будет действовать как переносчик или фомит для этого патогена, если вши покидают инфицированного хозяина и оседают на наивной рыбе.
Работа Pino-Marambio et al, Mordue и Birkett [13, 14] показала, что взрослые и недовозрастные особи будут повторно сортировать себя по рыбе в зависимости от наличия потенциальных партнеров, причем самцы в этом отношении гораздо более подвижны, чем самки. Была проведена некоторая работа по изучению морских вшей как переносчиков болезней, включая вирус инфекционного гематопоэтического некроза (IHNv), [8], вирус инфекционной анемии лосося (ISAv, [15]) и фурункулез [16].Эти исследования были сосредоточены на обнаружении присутствия патогена на взрослых морских вшах или внутри них, а не на полном исследовании передачи. [15,16] Основные патологические эффекты возникают в результате подвижных стадий, которые могут поглощать большое количество эпителиальной ткани, образуя большие поражения, через которые может проникнуть вторичная инфекция. Возможно, если подвижные стадии питаются рыбой, которая уже инфицирована патогеном, тогда она будет действовать как переносчик или фомит для этого патогена, если вши покидают инфицированного хозяина и оседают на наивной рыбе.
Способность передавать болезнь между людьми может быть увеличена с помощью L . salmonis способность модулировать иммунную систему хозяина. В последнее время было проведено множество исследований, показывающих, что взрослый лосось L подавляет воспалительные сигналы и клеточную иммунную систему хозяина [17–22]. Это считается преимуществом для халимуса и подвижной стадии, предотвращая образование комплемент-ассоциированного Т h 1, клеточно-опосредованного ответа на паразита.Провоспалительная реакция — основной механизм, используемый L . salmonis кижуч устойчив к успешному прикреплению вшей [17, 23].
Вирус инфекционной анемии лосося представляет собой ортомиксовирус и этиологический агент инфекционной анемии лосося (ISA, [24–27]). ISA — это болезнь, внесенная в список Всемирной организации здравоохранения животных (МЭБ), которая представляет собой экономическую проблему для лососевого хозяйства в Чили, Канаде, Норвегии, Шотландии, Фарерских островах и США [26, 28–30].:max_bytes(150000):strip_icc()/head-louse-01-115944610-5bfd8befc9e77c0051d00287.jpg) Клинические признаки могут включать анемию, желтый или кровянистый асцит, геморрагический некроз печени, экзофтальмию, летаргию и повышенную смертность [31, 32]. Кумулятивная смертность из-за инфекции ISAv может сильно варьироваться от незначительной до более 90% популяции рыб. зависит от штамма ISAv, генетического фона рыб и других факторов стресса. Есть некоторые эпидемиологические данные, свидетельствующие о том, что вспышки ISA связаны с заражением морскими вшами [33, 34].
Клинические признаки могут включать анемию, желтый или кровянистый асцит, геморрагический некроз печени, экзофтальмию, летаргию и повышенную смертность [31, 32]. Кумулятивная смертность из-за инфекции ISAv может сильно варьироваться от незначительной до более 90% популяции рыб. зависит от штамма ISAv, генетического фона рыб и других факторов стресса. Есть некоторые эпидемиологические данные, свидетельствующие о том, что вспышки ISA связаны с заражением морскими вшами [33, 34].
В связи с экономическими последствиями этих двух патогенов в данном исследовании изучали, если L . лосося заражения атлантического лосося: 1) повышенная восприимчивость лосося к инфекции ISAv и 2) повлияла на системный иммунный ответ на последующую инфекцию ISAv. Чтобы ответить на эти вопросы, лосось подвергался воздействию: 1) вшей без ISAv, 2) без вшей плюс ISAv и 3) вшей плюс ISAv 4) вшей без ISAv и последующей выживаемости, регистрировали распространенность ISAv и экспрессию иммунных генов.
Методы
Заявление об этике
Представленное исследование было оценено Комитетом по уходу и использованию животных Университета штата Мэн (IACUC).Все экспериментальные планы и протоколы были рассмотрены и одобрены до проведения любых исследований. Университет штата Мэн зарегистрирован как исследовательский центр в соответствии с Законом Министерства сельского хозяйства США о защите животных и Политикой службы общественного здравоохранения в отношении гуманного ухода и использования лабораторных животных. В Университете штата Мэн находится Управление по защите лабораторных животных (OLAW) Национального института здравоохранения по обеспечению здоровья позвоночных животных, используемых в исследованиях, обучении и информационно-просветительской работе.В соответствии с Политикой службы общественного здравоохранения в отношении гуманного ухода и использования лабораторных животных, Университет штата Мэн работает с OLAW Национальных институтов здравоохранения, чтобы обеспечить благополучие животных, используемых в исследованиях и обучении благополучию животных, Гарантия №: A3754 -01. Лабораторные инвазии и инфекции атлантического лосося L . salmonis и ISAv проводились в соответствии с утвержденным протоколом IACUC Университета штата Мэн A2012-11-06.
Рыбоводство
атлантического лосося (ATS) были выращены из икры в Национальном центре морской аквакультуры в холодных водах, Франклин, штат Мэн, и были признаны свободными от конкретных патогенов на основании долгой истории этого учреждения по проверке здоровья рыб.ATS были помечены внутрибрюшинно с помощью пассивных интегрированных транспондеров (PIT) с помощью 7-миллиметровых тегов PIT (NMT Inc) в качестве парр, чтобы различать семейный статус, и были переданы в системы морской воды в виде смолтов. Эти акклиматизированные в соленой воде САР использовались для проведения испытаний в искусственной морской воде в Университете штата Мэн. Семейства, полученные из реки Пенобскот и реки Сент-Джон, дополнительно были дифференцированы с помощью эластомерного мечения (NMT Inc., Вашингтон, США) для облегчения отбора проб.
Выращивание морских вшей
Беременная, взрослая самка L . лосося были собраны на коммерческих фермах в штате Мэн, любезно предоставлены Cooke Aquaculture. Вшей в собранной морской воде перевозили в аэрированной естественной морской воде в Исследовательский институт аквакультуры при Университете штата Мэн. У взрослых вшей удаляли яичные нити и помещали в камеры для вылупления в системе рециркуляции естественной морской воды при 13 ± 1 ° C и солености 33 ± 1 ppt. После того, как личинки вшей перешли на стадию инфицирования копеподид, их собирали с помощью выводных камер с размером ячеек 64 мкм в стеклянный контейнер и считали готовыми к заражению атлантическим лососем в ванне.Для заражения использовались только копеподиды возрастом менее 4 дней.
Обслуживание ячеек ISAv и ASK II
Клетки почки атлантического лосося II (ASK II) (Micro Technologies Inc. Richmond, ME) поддерживали в среде для культивирования клеток Leibovitz-15 (L-15) (Invitrogen, MD) с 10% FBS (Gibco, Fisher Scientific, Waltham, MA) и 4 мкл 2-меркаптоэтанола (помогает поддерживать восстанавливающую среду, Fisher Scientific).
Штамм ISAv Charlie Cove Back Bay (CCBB) (Micro Technologies Inc.Ричмонд, Мэн) на протяжении всего исследования. Этот штамм был выделен из инфицированного атлантического лосося в Чарли Коув Бэк Бэй, Нью-Брансуик, Канада в 1997 году. Изоляты ISAv размножали в клетках эмбриона чавычи (CHSE-214) (коллекция клеток Университета штата Мэн), выращенных при 15 ° C в MEM, содержащем 5% FBS. Когда клетки продемонстрировали 75% цитопатический эффект (ЦПЭ), клетки и супернатант собирали и центрифугировали при 1000g в течение 10 минут для удаления клеток и дебриса. Супернатант, содержащий ISAv, фильтровали через фильтр 0.Фильтр 45 мкм (EMD Millipore, Массачусетс, США), аликвоты на 5,0 мл аликвоты и хранили при -80 ° C до тех пор, пока не потребуется.
Титр инокулята ISAv для внутрибрюшинной инъекции совместно обитающих рыб определяли с помощью анализа конечных точек TCID 50 в клетках ASK, выращенных при 15 ° C в среде L-15 с 5% FBS. Вкратце, инокулят вируса разводили 1:10 в среде L-15, содержащей гентамицин (50 мкг · мл -1 , L-15-G), и фильтровали через фильтры 0,45 мкм. Готовили серийные 10-кратные разведения до 10 -9 в среде L-15-G.Каждое разведение вируса L-15-G добавляли в объемах 100 мкл в девять лунок 96-луночного планшета, засеянного клетками ASK II. Планшеты закрывали майларовым листом и центрифугировали в течение 30 минут при 15 ° C при 500xg для усиления адсорбции [35]. Затем планшеты инкубировали при 15 ° C. Все планшеты ежедневно наблюдались на предмет видимого CPE в течение 28 дней. TCID 50 был рассчитан с использованием метода Рида и Мюнча [36].
Рыбоводство
Рыбы были разделены на 3 группы обработки: 1) контрольная группа, 2) группа, инфицированная только ISAv, и 3) группа, инфицированная вшами + ISAv (рис. 1).Четыреста двадцать три атлантических лосося из двух штаммов, происходящих из реки Пенобскот и Сент-Джон, были случайным образом распределены по 18 резервуарам (6 дублирующих резервуаров на обработку) искусственной системы рециркуляции соленой воды с УФ-стерилизацией. Перед началом испытаний рыб акклиматизировали в течение 3 недель. Каждая популяция лосося состояла из 3 племенных семей, то есть всего 6 племенных семей. Параметры воды были следующими: 12 ± 1 ° C, 10 ± 2 ppm растворенного кислорода, 34 ± 1 ppt солености, комнатное освещение было зафиксировано на 12:12 дневной свет / темнота.Чтобы предотвратить перекрестное загрязнение при последующей фильтрации и повторной оксигенации воды, рециркулирующая вода подвергалась УФ-дезинфекции (Emperor Aquatics 80 Вт Smart UV) перед возвращением воды в каждый отдельный экспериментальный резервуар.
Рис. 1. Схема испытания.
Три группы атлантического лосося из штамма Penobscot river и штамма St John river (шесть дублирующих резервуаров на обработку): заражение морскими вшами плюс ISAv, заражение морскими вшами без ISAv и отсутствие заражения морскими вшами без контроля ISAv.Рыбы были заражены в ванне L . salmonis с последующей инфекцией совместного проживания ISAv через 18 дней после контакта со вшами. Двадцать четыре рыбы были подвергнуты эвтаназии в каждой экспериментальной группе (n = 12 рыб, полученных из Пенобскота, и 12 рыб, полученных из Сент-Джона, каждая из трех отдельных семейств) в дни -1, 3, 16 и 37 дней на день, и были взяты образцы следующих параметров количество вшей на рыбу, головную почку для экспрессии иммунного гена и почку, селезенку и сердце ISAv QRT-PCR для клеточной культуры. Также наблюдали за сорок пятью атлантическими лососями в каждой экспериментальной группе до тех пор, пока ни в одной из групп не прекратилась смертность в течение 7 дней.При 51 д.п.в. все выжившие рыбы были отобраны, как описано ниже.
https://doi.org/10.1371/journal.pone.0209178.g001
Заражение морскими вшами
Рыба была заражена в ванне л . лососей копеподид, остановив поток воды и уменьшив количество воды до 1/3 -го первоначального объема резервуара, модифицированного из Bron [37]. Копеподидов добавляли в соотношении 150 на рыбу. Подача воды восстанавливалась через 2 часа. Во время процедуры заражения постоянно контролировали температуру воды и растворенный кислород.Группы лечения, которые не заразились вшами, прошли ту же процедуру без копеподид, чтобы подвергнуть рыбу одинаковому процессу обращения. Сточные воды из резервуаров проходили через мешки с сеткой 100 мкм, гранулированный фильтр и УФ-стерилизацию перед рециркуляцией через резервуары, чтобы предотвратить попадание неприкрепленных вшей в контрольные резервуары.
Заражение ISAv
После того, как вши начали линять до подвижных стадий до взрослой особи, через 18 дней после заражения (dpi), заражение, фиктивное воздействие на вшей, группы рыб только с ISAv и вши + ISAv подвергались воздействию ISAv посредством контрольного заражения.Десять процентов популяции резервуаров были отобраны случайным образом (с использованием таблиц случайных чисел) и анестезированы 80 мг. Л -1 MS-222, внутрибрюшинно (внутрибрюшинно) инъецировано 1 x 10 4,4 TCID 50 ISAv на рыбу разводили в стерильном фосфатно-солевом буфере (PBS, объем 100 мкл), и жировой плавник обрезался для целей идентификации. Контрольная группа подверглась той же процедуре, за исключением того, что 10% населения были внутрибрюшинно. вводили только 100 мкл стерильного PBS.Эти i.p. инъецированную рыбу (ISAv + / ISAv –) до конца исследования называли «рыбой-сбросильщиком».
Экспериментальный дизайн, испытание с
L . Лосось с последующей ISAv и процедурой отбора пробОбразцы рыбы были отобраны до возникновения каких-либо инфекций, т. Е. Базально (n = 24), через 17 дней после заражения (dpi) для морских вшей и минус 1 dpi для ISAv cohab (n = 24 / группа), 21 dpi для морских вшей и 3 dpi. для ISAv cohab (n = 24 / группа), 34 dpi для морских вшей и 16 dpi для ISAv cohab (n = 24 / группа) и 55 dpi для морских вшей и 37 dpi для ISAv cohab (n = 24 / группа, рис. ).Выживаемость также контролировалась в дублирующих резервуарах для каждой обработки без отбора проб в этих резервуарах.
Установлена гуманная конечная точка после вызова ISAv
Использование гуманной конечной точки использовалось при необходимости во время эксперимента. Проблема ISAv привела к болезням и гибели рыб. Однако после заражения за рыбами наблюдали как минимум три раза в день. Это позволяло проводить гуманную эвтаназию как можно ближе к тому моменту, когда люди явно проявляли признаки необратимого стресса.Любая умирающая рыба была подвергнута эвтаназии, а также вся рыба, проявлявшая признаки недомогания, такие как респираторное дыхание, вялость и потеря равновесия, которые, как было установлено, достигли конечной стадии болезни.
Сбор и обработка проб
В каждой точке отбора проб рыбу умерщвляли 400 мг. Л. -1 MS-222 (Sigma, Сент-Луис, Миссури) в отдельных 40-литровых контейнерах. Для каждой рыбы регистрировали длину, вес и запас. Ткани почек, сердца и селезенки помещали в стерильные мешочки для смесителей Steward Stomacher Lab (Fisher Thermo Scientific).Ткани взвешивали, разводили 1/5 (мас. / Об.) В стерильном PBS (Sigma) и гомогенизировали. Эти образцы на протяжении всей обработки находились на льду. Образцы передней почки были вырезаны и помещены индивидуально в RNA Later (Ambion Inc., Остин, Техас) на 48 часов при 4 ° C перед удалением РНК. Позднее и хранение при -80 ° C до транспортировки на сухом льду в Атлантический ветеринарный колледж. (AVC), Шарлоттаун, PE, Канада, за анализ экспрессии генов. Количество морских вшей на каждой рыбе также подсчитывалось и классифицировалось как сидячих (халимус I или II), подвижных (недоношенных и взрослых) или беременных (взрослая самка с нитями икры).
Извлечение РНК и обратная транскрипция
Суммарная РНК была экстрагирована из образцов передней почки с использованием Trizol Reagent [38–40], 1993 в соответствии с инструкциями производителей. Приблизительно 50 мг ткани добавляли к 1,5 мл Tri Reagent [41] и механически мацерировали с помощью гомогенизатора (VWR, Mississauga, ON). После 5 мин инкубации при комнатной температуре (RT, ~ 22 ° C) к каждому образцу добавляли 300 мкл хлороформа (BDH, West Chester, PA). Пробирки закрывали крышками и энергично встряхивали в течение 15 с.Затем была 3-минутная инкубация при комнатной температуре, образцы центрифугировали при 10000 g в течение 15 минут при 4 ° C. Водную фазу переносили в новую пробирку на 1,5 мл. Добавляли равный объем изопропилового спирта молекулярной чистоты (Sigma), и пробирки перемешивали, переворачивая 3 раза, а затем инкубировали в течение 10 минут при комнатной температуре. РНК осаждали центрифугированием при 10 000 g в течение 10 мин при 4 ° C. Затем осадки промывали 750 мкл ледяного 75% (об. / Об.) Этанола молекулярной чистоты (BDH) и центрифугировали при 7500g в течение 5 минут при 4 ° C.Осадки РНК сушили на воздухе примерно 5 мин. Осадки ресуспендировали в 100–200 мкл воды, свободной от нуклеаз, перед количественным определением на спектрофотометре NanoDrop-2000 (Thermo Scientific, Wilmington, DE). Образцы хранили при -80 ° C до обработки ДНКазой.
Всего 5 мкг выделенной РНК обрабатывали ДНКазой с использованием набора TURBO DNase-free (Ambion, Foster City, CA), следуя инструкциям производителя. Случайный набор РНК из каждой ткани анализировали с помощью Experion (BioRad, Hercules, CA), и все числа целостности РНК (RIN) были> 6.5. Синтез кДНК выполняли на 1 мкг обработанной ДНКазой тотальной РНК с использованием системы обратной транскрипции (Promega, Madison, WI) и случайных гексамеров в соответствии с инструкциями производителей. кДНК хранили при -20 ° C до использования в КПЦР.
Подтверждение заражения ISAv методом RT-qPCR
пары праймеров и зонды Taqman MGB, нацеленные на сегмент 8 ISAv от Snow et al. (2006) были использованы для обнаружения ISAv (таблица 1). Каждую количественную ПЦР проводили в 96-луночном планшете (Eppendorf, Mississauga, ON) в стандартных условиях в реакциях объемом 20 мкл, содержащих 1x анализ экспрессии генов TaqMan (Applied Biosystems, Foster City, CA), 1x мастер-смесь экспрессии генов TaqMan (Applied Biosystems, Фостер-Сити, Калифорния) и 2 мкл кДНК (разведенных 1:10 в воде, свободной от нуклеаз).Отрицательный матричный контроль воды, свободной от нуклеаз, использовали в серии реакций для скрининга на возможное перекрестное загрязнение между образцами. Кроме того, был проведен положительный контроль, сделанный из идентифицированных образцов, инъецированных ISAv, для проверки обнаружения и непрерывности между планшетами. Каждый образец анализировали в двух экземплярах, и если значения Ct между повторами составляли> 0,5 цикла, образец повторно запускали на отдельном планшете. Анализы проводили в Eppendorf Mastercycler ep realplex 2 при следующих условиях: начальная инкубация при 50 ° C в течение 2 минут, затем 95 ° C в течение 10 минут, затем 45 циклов амплификации денатурации при 95 ° C в течение 15 секунд и отжиг / удлинение при 60 ° C в течение 1 мин.
Подтверждение инфекции ISAv с помощью культуры клеток ASK II
Жизнеспособный ISAv был выделен методами культивирования клеток с методом усиленной адсорбции вируса [35]. Гомогенаты ткани почек, селезенки и сердца дополнительно разбавляли 1/10 (об. / Об.) В среде L-15-G и фильтровали через фильтры 0,45 мкм. Каждый образец добавляли в объеме 100 мкл в две лунки 24-луночного планшета, содержащего клетки ASK II, с культуральной средой, удаленной из лунок. Затем планшеты центрифугировали в течение 30 мин при 15 ° C и 500xg для усиления адсорбции вируса перед добавлением 1 мл L-15 с добавлением 5% (об. / Об.) FBS.Планшеты закрывали листом майлара и инкубировали при 15 ° C. Все планшеты ежедневно контролировали на предмет видимого CPE в течение 28 дней. Все образцы с наблюдаемым CPE ISAv были подтверждены обнаружением сегмента ISAv с помощью RT-PCR. Все образцы, обработанные от падежа и выживших рыб, независимо от того, наблюдался CPE или нет, а также 1/3 rd образцов всех временных точек, которые были отрицательными на CPE, также были протестированы с помощью RT-PCR для подтверждения (таблица 2).
Таблица 2. Средний процент атлантического лосося, положительного по жизнеспособным ISAv в культуре клеток и нежизнеспособным ISAv по данным QRT-PCR, обнаружение РНК сегмента 8 ISAv до и 3, 16, 37 доп.
Рыба отобрана при 51 д.п.в. чтобы сожители ISAv выжили после заражения.
https://doi.org/10.1371/journal.pone.0209178.t002
Лунки с культурами клеток соскребали для удаления монослоя клеток ASK, и содержимое лунок собирали в асептических условиях перед центрифугированием при 20 000 g в течение 15 мин при 4 ° C. . Тотальную РНК экстрагировали из осадка и примерно 250 мкл супернатанта клеточной культуры с использованием реагента Trizol LS (Invitrogen) в соответствии с инструкциями производителя с добавлением 0.02 нг. мкл -1 линейного акриламида (Ambion) в водную фазу перед добавлением 500 мкл изопропанола молекулярной чистоты (Fisher). Суммарную РНК определяли количественно на спектрофотометре NanoDrop-1000 (Fisher Scientific) перед хранением при -80 ° C.
Синтез кДНК проводили на 10 мкл изолированной РНК с использованием набора для обратной транскрипции кДНК высокой емкости с ингибитором РНКазы (Applied Biosystems) и случайными гексамерами в соответствии с инструкциями производителей. кДНК хранили при -20 ° C до тестирования ПЦР.
ПЦР-детектирование сегмента 8 ISAv [25] проводили с использованием праймеров, приведенных в таблице 3. ПЦР выполняли в стандартных условиях в 50 мкл реакционной смеси, содержащей 5 мкл кДНК, 1x мастер-смесь ДНК-полимеразы Go Taq flexi (Promega), 0,2 мМ каждого dNTP ( Promega), 0,5 мкМ прямого и обратного праймеров (IDT), 1,25 U Go Taq ДНК-полимеразы (Promega) и 1,5 мМ MgCl 2 (Promega). Отрицательный безматричный контроль воды, свободной от нуклеаз (IDT), использовали для скрининга на возможное перекрестное загрязнение между образцами.Кроме того, был проведен положительный контроль кДНК, полученной из идентифицированных образцов культуры клеток рыб, инъецированных ISAV, для проверки обнаружения. ПЦР проводили в термоциклере BioRad DNA Engine при следующих условиях: начальная денатурация при 95 ° C в течение 10 мин, затем 35 циклов амплификации денатурации при 95 ° C в течение 60 с, отжиг при 55 ° C в течение 60 с и удлинение при 72 o C в течение 60 с с последующей стадией конечного удлинения при 72 ° C в течение 7 минут. Продукты ПЦР разделяли на 2% (мас. / Об.) Агарозном геле, содержащем 0.5 мкг / мл -1 бромид этидия (Fisher) с лестницей 100 пар оснований (NEB) и изображение.
Экспрессия иммунного гена с помощью RT-qPCR
Наборы праймеров для 4 эталонных генов (EF-1Ab, RSP20, 18S и elF) и 7 интересующих генов (интерлейкин (IL) -1β, матриксная металлопротеиназа (MMP) 9, Mx1, главный комплекс гистосовместимости класса I – бета (MCh2 — β), галектин 9, трехчастный мотив (TRIM) 16 и TRIM 25) были получены из предыдущей литературы (таблица 4). Каждую кПЦР проводили в 96-луночном планшете (Eppendorf, Mississauga, ON), комбинируя 0.5 мкл прямого праймера (10 мкМ), 0,5 мкл (10 мкМ) обратного праймера, 5 мкл 2x GoTaq qPCR Master Mix (Promega), 3 мкл воды, свободной от нуклеаз (Lonza, Rockland, ME) и 2 мкл кДНК ( разбавленный 1:10 в воде, свободной от нуклеаз). КПЦР выполняли с использованием системы CFX Connect Real-Time (BioRad, Hercules, CA) в следующих условиях: начальная денатурация 5 минут при 95 ° C, затем 40 циклов амплификации при 95 ° C в течение 15 секунд, отжиг в течение 20 секунд и удлинение. в течение 30 с при 72 ° C. Температуры отжига варьировались в зависимости от используемых праймеров.18 S, elF, MMP 9 и TRIM 16 были отожжены при 61,6 ° C, RPS 20, Mx1, MHC1-b, Galectin 9 и TRIM 25 были отожжены при 64 ° C, а EF-1Ab и IL-1β отожжены при 65 ° С. В конце каждой количественной ПЦР проводили анализ кривой плавления, чтобы гарантировать, что амплифицирован только один продукт.
Таблица 4. Наборы олигонуклеотидных праймеров, используемые для амплификации эталонных генов атлантического лосося ( Salmo salar ) (EF-1Ab, RPS 20, 18S и elF) и генов-мишеней (IL-1β, MMP 9, Mx1, MHC1-b, галектин 9, TRIM 16 и TRIM 25) для количественных исследований экспрессии ПЦР в реальном времени (qPCR).
https://doi.org/10.1371/journal.pone.0209178.t004
Анализ данных
Анализ данных выполнялся с помощью GraphPad Prism v7.0. Долю рыб, положительных по жизнеспособным ISAv, анализировали с использованием непараметрического анализа Краскела-Уоллиса с тестом множественного сравнения Данна. Кривые выживаемости анализировали с использованием сравнения кривых выживаемости с помощью лог-рангового критерия Мартеля-Кокса. Результаты экспрессии генов анализировали с помощью программного обеспечения BioRad CFX Manager v3.0. Эффективность праймеров (E = 10 (-1 / наклон) ) определяли путем анализа 10-кратных серийных разведений для эталонных генов и 5-кратных серийных разведений для представляющих интерес генов с использованием объединенной кДНК.Средняя эффективность составила 2,03 ± 0,03 для всех генов. Стабильность EF-1Ab, RSP 20, 18 S и elF в качестве эталонных генов оценивали с помощью приложения qBasePLUS GeNorm [42]. Все четыре контрольных гена считались стабильными и поэтому использовались для расчета среднего нормализованного относительного количества (MNRQ) транскриптов целевого гена (значение M <1,0, коэффициент вариации [CV] <0,5). Перед статистическим анализом все образцы были далее нормализованы по базовым образцам, взятым до каких-либо инфекций (n = 24).Любой «эффект резервуара» в рамках экспериментального плана был проанализирован перед дальнейшим статистическим анализом с помощью двухфакторного дисперсионного анализа. Во всех случаях не наблюдалось статистической значимости между группами, присутствующими в каждом резервуаре, и не наблюдалось никакого «эффекта резервуара».
Результаты
Интенсивность заражения морскими вшами
Воздействие совместного проживания ISAV началось через 17 дней после заражения вшами (d.p.l.i., рис. 2). Это было выбрано в качестве точки, в которой рыба подвергается воздействию ISAv, поскольку вши наносят наибольший урон хозяину во время подвижных стадий.Беременные самки вшей присутствовали на рыбе только в более поздние моменты времени отбора проб — 37 и 51 день после контакта (d.p.e.) с проливающей рыбой (ISAv + cohab), то есть 55 и 69 d.p.l.i. (Рис 2). Вшей не было обнаружено ни на одной рыбе, взятой в контрольной группе или группе обработки только ISAv.
Рис. 2. Среднее количество сидячих, подвижных или беременных морских вшей на атлантического лосося до (день 0) и 3, 16, 37 и 51 день после заражения сожительством ISAv, что соответствует 17, 21, 34, 55 и 69 дням пост-вшей соответственно.
https://doi.org/10.1371/journal.pone.0209178.g002
Доля лосося с положительной реакцией на ISAv
Атлантический лосось, предварительно зараженный л . лососей были положительными на жизнеспособные ISAv ранее, на 16 d.p.e. по ISAV + , чем рыбы без предшествующего заражения морскими вшами (только ISAv), которые сначала оказались положительными для жизнеспособных ISAv при 37 d.p.e. к ISAv + рыба-шеддер (рис. 3). Доля лосося с предшествующим заражением морскими вшами, положительными по жизнеспособным ISAv, была только значительно выше, чем доля рыб без предшествующего заражения морскими вшами через 16 дней после контакта с рыбой-проливной ISAv + (p <0.05, рис 3). Однако доля лососей с предшествующим заражением морскими вшами, положительными для жизнеспособных ISAv, была значительно выше, чем у рыб с датами 16 и 37 дней на день на ISAV + рыб-проливающих (p <0,05), даже несмотря на то, что не было значительной разницы между контрольная группа и группа без вшей плюс ISAv в любой из этих временных точек. Отобранная рыба 51 д.э. к ISAV + рыба-шеддер пережила воздействие ISAv, но оказалось, что она является носителем жизнеспособной ISAv. Не было значительной разницы между долей «выживших» рыб, положительных по жизнеспособным ISAv, в группах с или без предшествующего заражения морскими вшами (рис. 3).
Рис. 3. Средний процент атлантического лосося, положительных на ISAv в культуре клеток до и через 3, 16, 37 и 51 день после заражения сожительством ISAv.
Рыба отобрана при 51 д.п.в. к ISAv рыбы-сожители пережили инфекцию ISAv. Данные объединяют из четырех повторных резервуаров для каждой обработки, при этом общее n на группу обработки составляет 24, за исключением группы лечения вшей плюс ISAv при 37 d.p.e. с ISAv-инфицированными рыбами сожительства, где n = 3 из-за высокой смертности и низкой выживаемости в этой экспериментальной группе.При 51 д.п.в. с зараженными ISAv рыбами-сожителями, то есть выжившими рыбами n = 45, 44 и 14 соответственно.
https://doi.org/10.1371/journal.pone.0209178.g003
Присутствие ISAv было подтверждено как ОТ-ПЦР-тестированием образцов клеточных культур, так и qRT-ПЦР образцов почек головы соответствующих рыб для сегмента 8 ISAv. РНК (Сноу и др., 2006). Образец считался положительным, если значение Ct было <37 циклов, и, следовательно, значения Ct> 37 считались отрицательными для присутствия РНК ISAv.
Выживаемость лосося в процентах
Атлантический лосось, зараженный л . лососей до воздействия ISAV + рыба-проливающая рыба имела значительно более низкий процент выживаемости после воздействия ISAV + рыбы-сбрасывателя, чем те, у которых не было предшествующей инфекции морскими вшами (без вшей плюс группа ISAv, p <0,0001, рис. ). Выживаемость также отслеживалась для контрольной группы рыб, которые были ложно заражены морскими вшами и подверглись фиктивному воздействию ISAv (i.е. шеддеры i.p. введен PBS, ISAV — ). Выживаемость лососей без предшествующей инфекции морскими вшами после контакта с рыбой-проливной ISAV + также была значительно ниже, чем у лососей, не подвергавшихся воздействию морских вшей или рыбы-проливающей ISAv + (p = 0,0443, рис. 4).
Рис. 4. Процент выживаемости атлантического лосося с предшествующим L и без него. salmonis заражение после контакта с зараженной ISAv сожелательной рыбой (учитывались только смертности, которые были положительными для жизнеспособных ISAv).
Объединенные данные из дублирующих резервуаров для каждой группы лечения: без вшей, без ISAv, без вшей плюс ISAv и вшей плюс ISAv (n = 47, 48 и 33 соответственно).
https://doi.org/10.1371/journal.pone.0209178.g004
Рыба-проливная, зараженная л . salmonis до i.p. инъекции ISAv (ISAv + ) имели значительно более низкий процент выживаемости, чем те, у которых ранее не было заражения морскими вшами (p <0,0001, рис. 5). Выживаемость также контролировалась для рыб-проливателей ISAv –, которые были ложно заражены морскими вшами и подвергнуты фиктивному воздействию ISAv.Процент выживаемости лосося с предшествующим заражением морскими вшами, после i.p. инъекции ISAv также были значительно ниже, чем у тех, кто не подвергался воздействию морских вшей или ISAv (p <0,0001, рис. 5).
Рис. 5. Выживаемость атлантического лосося в процентах с предшествующим L и без него. лосося после заражения — внутрибрюшинная инъекция ISAv.
Данные объединены из шести повторных резервуаров для каждой обработки (n = 18 на обработку).
https: // doi.org / 10.1371 / journal.pone.0209178.g005
Экспрессия гена, связанного с вшами
Результаты экспрессии генов IL-1β и MMP 9 использовали для оценки реакции рыб на заражение морскими вшами. Было обнаружено, что группы, зараженные морскими вшами, имели значительно более высокие уровни провоспалительного цитокина IL-1β и MMP 9 во все моменты времени, чем контрольная группа и группы, содержащие только ISAv (Фиг.6 и 7). Когда группы были разбиты на группы их исходного происхождения (Penobscot или Saint John), было обнаружено, что объединенные три семейства штамма Penobscot имели значительно более высокие уровни экспрессии IL-1β через 17 дней.p.e к морским вшам, то есть до воздействия ISAv, чем три комбинированных семейства штамма Saint John (рис. 8). Однако не было значительных различий между количеством вшей на рыбу в семьях Saint John и в семьях, полученных из семейства Пенобскот, независимо от стадии их жизни (рис. 9). Однако экспрессия IL-1β в семействе штаммов Saint John была значительно выше, чем у семейств штаммов Penobscot, при 21 день на вшей и 3 дня на вшей. в ISAv (рис. 8).
Рис. 6. Относительная нормализованная экспрессия провоспалительного цитокина IL1-β в передней почке атлантического лосося, подвергшегося воздействию как морских вшей, так и инфекций ISAv.
В трех группах обработки (контроль, только ISAv и ISAv + вши) были взяты пробы в 4 разных временных точках (17 дней после воздействия (dpe) на морских вшей и минус 1 dpe для ISAv, 21 dpe для вшей и 3 dpe для ISAv , 34 dpe для вшей и 16 dpe для ISAv, 55 dpe для вшей и 37 dpe для ISAv). Звездочка указывает на значительную разницу между контрольной и экспериментальной группами для этого конкретного момента времени (p <0,05, n = 24).
https://doi.org/10.1371/journal.pone.0209178.g006
Рис. 7. Относительная нормализованная экспрессия гена заживления ран MMP 9 в передней почке атлантического лосося, подвергшегося воздействию как морских вшей, так и инфекций ISAv.
В трех группах обработки (контроль, только ISAv и ISAv + вши) были взяты пробы в 4 разных временных точках (17 дней после воздействия (dpe) на морских вшей и минус 1 dpe для ISAv, 21 dpe для вшей и 3 dpe для ISAv , 34 dpe для вшей и 16 dpe для ISAv, 55 dpe для вшей и 37 dpe для ISAv). Звездочка указывает на значительную разницу между контрольной и экспериментальной группами для этого конкретного момента времени (p <0.05, n = 24).
https://doi.org/10.1371/journal.pone.0209178.g007
Рис. 8. Относительная нормализованная экспрессия провоспалительного цитокина IL1-β в передней почке атлантического лосося, подвергшегося воздействию как морских вшей, так и инфекции ISAv.
В трех группах обработки (контроль, только ISAv и ISAv + вши) были взяты пробы в 4 разных временных точках (17 дней после воздействия (dpe) на морских вшей и минус 1 dpe для ISAv, 21 dpe для вшей и 3 dpe для ISAv , 34 dpe для вшей и 16 dpe для ISAv, 55 dpe для вшей и 37 dpe для ISAv).Звездочка указывает на значительную разницу между контрольной и экспериментальной группами для этого конкретного момента времени (p <0,05, n = 24).
https://doi.org/10.1371/journal.pone.0209178.g008
Рис. 9. Среднее количество сидячих, подвижных или беременных морских вшей на атлантического лосося из трех объединенных семейств, полученных из племени Сент-Джон или Пенобскот, до и 3 , 16, 37 и 51 день после заражения сожительством ISAv, что соответствует 17, 21, 34, 55 и 69 дням после заражения вшами, соответственно.
Нет значительных различий в количестве сидячих, подвижных или беременных вшей на рыбу между двумя популяциями в любой из выбранных временных точек.
https://doi.org/10.1371/journal.pone.0209178.g009
Экспрессия гена, связанного с ISAv
При 37 dpe для зараженных ISAv рыб слитка группа и со вшами, и с ISAv имела значительно более высокую экспрессию Mx1, чем только ISAv и контрольная группы (фиг. 10). Когда группы обработки были разбиты на две группы происхождения, было обнаружено, что уровень экспрессии Mx1 в трех комбинированных семьях рыб, полученных из Сент-Джона, подвергшихся воздействию ISAv при 3 dpe, был значительно выше, чем уровень экспрессии Mx1, наблюдаемый в трех комбинированных семьях. тестируемого штамма Penobscot (рис. 11).Также было обнаружено, что три комбинированные протестированные семьи Сент-Джон обладали значительно более низкой выживаемостью после воздействия ISAv, чем штамм Penobscot, независимо от того, присутствовала ли предшествующая инфекция вшей или нет (p = 0,0211 и p = 0,0309, соответственно, рис. 12). По-прежнему наблюдалась значительно более низкая выживаемость в стадах St John и Penobscot, которые подвергались воздействию L . salmonis до воздействия ISAv по сравнению с рыбами, подвергшимися только воздействию ISAv (p <0,0001 для обоих, рис. 12).
Рис. 10. Относительная нормализованная экспрессия Mx-1 в передней почке атлантического лосося, подвергшегося воздействию как морских вшей, так и инфекций ISAv.
В трех группах обработки (контроль, только ISAv и ISAv + вши) были взяты пробы в 4 разных временных точках (17 дней после воздействия (dpe) на морских вшей и минус 1 dpe для ISAv, 21 dpe для вшей и 3 dpe для ISAv , 34 dpe для вшей и 16 dpe для ISAv, 55 dpe для вшей и 37 dpe для ISAv). Звездочка указывает на значительную разницу между контрольной и экспериментальной группами для этого конкретного момента времени (p <0.05, n = 24).
https://doi.org/10.1371/journal.pone.0209178.g010
Рис. 11. Относительная нормализованная экспрессия Mx-1 в передней почке атлантического лосося, подвергшегося воздействию как морских вшей, так и инфекции ISAv.
В трех группах обработки (контроль, только ISAv и ISAv + вши) были взяты пробы в 4 отдельных временных точках (17 дней после воздействия (dpe) на морских вшей и минус 1 dpe на ISAv, 21 dpe на вшей и 3 dpe на вшей). ISAv, 34 dpe для вшей и 16 dpe для ISAv, 55 dpe для вшей и 37 dpe для ISAv). Звездочка указывает на значительную разницу между контрольной и экспериментальной группами для этого конкретного момента времени (p <0,05, n = 24).
https://doi.org/10.1371/journal.pone.0209178.g011
Рис. 12. Процент выживаемости атлантического лосося, полученного из Сент-Джона и Пенобскота, с предшествующим L и без него. salmonis заражение после контакта с зараженной ISAv рыбой сожителя.
Объединение данных из дублирующих резервуаров для каждой группы обработки: без вшей, без ISAv, без вшей, плюс ISAv, и вшей, плюс ISAv (St John против рыб, полученных из Пенобскота, n = 15 и 29, n = 23 и 25, n = 17 и 26, соответственно).
https://doi.org/10.1371/journal.pone.0209178.g012
В моменты времени минус 1, 3 и 16 d.p.e. по отношению к шеддерам ISAv + , группы, зараженные вшами, имели значительно более низкие уровни экспрессии MCh2-ß, чем контрольная группа и группы, содержащие только ISAv (фиг. 13). Повышение экспрессии MHC1-ß не происходило до 37 dpe к ISAv в группе, инфицированной вшами + ISAv.
Рис. 13. Относительная нормализованная экспрессия MHC класса I β в передней почке атлантического лосося, подвергшегося воздействию как морских вшей, так и инфекций ISAv.
В трех группах обработки (контроль, только ISAv и ISAv + вши) были взяты пробы в 4 разных временных точках (17 дней после воздействия (dpe) на морских вшей и минус 1 dpe для ISAv, 21 dpe для вшей и 3 dpe для ISAv , 34 dpe для вшей и 16 dpe для ISAv, 55 dpe для вшей и 37 dpe для ISAv). Звездочка указывает на значительную разницу между контрольной и экспериментальной группами для этого конкретного момента времени (p <0,05, n = 24).
https://doi.org/10.1371/journal.pone.0209178.g013
Уровни экспрессии генов галектина 9, TRIM 16 и TRIM 25 все использовали в качестве меры соответствующей реакции рыбы-хозяина на инфекцию ISAv. Паттерн экспрессии всех трех генов, галектина-9, TRIM 16 и TRIM 25, был сходным для разных групп и временных точек. Как при минус 1, так и при 3 dpe для ISAv, группы, зараженные вшами, показали подавление экспрессии гена галектина 9 по сравнению с контрольной группой и группами только с ISAv (фиг. 14). К 16 dpe к ISAv в группе, инфицированной вшами плюс ISAv, уровень галектина 9 вернулся к уровням, аналогичным уровням как в контрольной группе, так и в группе только ISAv (фиг. 14).Опять же, аналогично другим измеренным генам, галектин-9 был значительно выше в группе вшей + ISAv, чем у всех других рыб в последний день отбора проб (рис. 14). Та же картина сохранялась для экспрессии генов TRIM 16 и TRIM 25, за исключением того, что экспрессия гена TRIM 25 в группе, зараженной вшами, продолжала демонстрировать более низкую экспрессию гена при 16 dpe для ISAv по сравнению как с контрольной группой, так и с группой только ISAv.
Рис. 14. Относительная нормализованная экспрессия гена галектина 9, отвечающего за ISAv, в передней почке атлантического лосося, подвергшегося воздействию как морских вшей, так и инфекций ISAv.
В трех группах обработки (контроль, только ISAv и ISAv + вши) были взяты пробы в 4 разных временных точках (17 дней после воздействия (dpe) на морских вшей и минус 1 dpe для ISAv, 21 dpe для вшей и 3 dpe для ISAv , 34 dpe для вшей и 16 dpe для ISAv, 55 dpe для вшей и 37 dpe для ISAv). Звездочка указывает на значительную разницу между контрольной и экспериментальной группами для этого конкретного момента времени (p <0,05, n = 24).
https://doi.org/10.1371/journal.pone.0209178.g014
Не было значительных различий в экспрессии генов галектина-9, TRIM 16 или TRIM-25 между популяциями лосося, полученными из Пенобскота и Сент-Джона, исследованных в любой из точек отбора проб в пределах определенной экспериментальной группы.
Обсуждение
Это первое лабораторное исследование воздействия заражения Lepeophtheirus salmonis на последующую восприимчивость лосося к ISAv. Хотя заражение морскими вшами долгое время считалось вектором ISAv и / или нарушением способности хозяина реагировать на коинфекцию вирусной инфекцией [43–45], это первое исследование, которое убедительно показывает, что предшествующее заражение морскими вшами увеличивается. восприимчивость лосося к ISAv.Доля лососей с предшествующим заражением морскими вшами, которые были положительны в отношении жизнеспособных ISAv, была значительно выше, чем у контрольных рыб без вшей без ISAv при 16 и 37 днях дня на рыбу ISAv cohab (p <0,05), даже несмотря на то, что не было существенной разницы между контрольной группы и группы без вшей плюс ISAv в любой из этих временных точек. Это говорит о том, что атлантический лосось с высокой подвижностью L . лососей были гораздо более восприимчивы к инфекции ISAv из-за сожительства, поскольку жизнеспособный вирус был обнаружен в более ранний момент времени после заражения ISAv.Также не было значимой разницы в выживаемости между контрольной группой без вшей без ISAV и группой без вшей плюс ISAV (p = 0,0713, рис. 5). Эти данные позволяют предположить, что атлантический лосось обладает высокой подвижностью L . Salmonis более восприимчивы к инфекции ISAv через i.p. инъекции из-за того, что эти рыбы обладали более высокой смертностью без выживаемости по сравнению с рыбами i.p. вводили ISAv без предшествующего заражения вшами, что приводило к значительно более низкой смертности.Тот факт, что вши плюс рыба ISAv умирали быстрее со 100% смертностью на 32 d.p. i.p. заражение могло привести к более раннему распространению вируса или к большему распространению вируса в резервуарах для заражения сожительством и, следовательно, к более раннему обнаружению жизнеспособных ISAv у сожительских рыб, зараженных вшами, при 16 d.p.e. к рыбе ISAv + cohab.
Изоляция вируса
Выделение вирусас использованием клеточной культуры, как было установлено, имеет высокую специфичность в отношении ISAv, но может иметь меньшую чувствительность, чем qPCR McClure [44].Однако количественная ПЦР не делает различий между жизнеспособными и нежизнеспособными частицами ISAv и может приводить к ложноположительным результатам, снижая специфичность. Было обнаружено, что анализ кПЦР, использованный в этом исследовании, имеет специфичность 99% [44]. Более того, McClure и др. [44] предположили, что при скрининге больших размеров выборки, как в текущем исследовании, может быть получено большее количество ложноположительных результатов. В текущем исследовании все рыбы, не подвергавшиеся воздействию ISAv, дали отрицательный результат на присутствие РНК ISAv, за исключением одной рыбы через 37 дней.p.e и два случая смерти, все из которых произошли в группе фиктивной инфекции ISAv. Эти три рыбы дали положительный результат на РНК ISAv с помощью qRT-PCR, но отрицательный на жизнеспособный вирус с помощью клеточной культуры и последующей RT-PCR. Никаких других смертей в контрольной группе не было, и два положительных результата кПЦР не показали клинических признаков ISAv. Возможное объяснение присутствия низких количеств РНК ISAv у трех рыб из контрольных групп, не сосуществующих с рыбами, которым вводили ISAv, заключается в том, что они подвергались нежизнеспособному воздействию ISAv, которое было распространено инфицированными рыбами в других резервуарах того же самого аквариума. система рециркуляции, которая была инактивирована процессом УФ-стерилизации перед попаданием в резервуары, не подвергшиеся воздействию ISAv.Эти наблюдения в сочетании с нулевым показателем другой смертности в контроле и высоким уровнем смертности в группах, подвергшихся воздействию ISAv, предполагают возможное заражение и ложноположительные результаты. В целом, образцы, которые были положительными с помощью кПЦР на РНК ISAv, но не из группы лечения, подвергшейся воздействию ISAv, встречались со скоростью 1,3%, что соответствует 99% специфичности, как определено Murray et al [46] и Snow [47]. ]. Следует отметить, что контрольные группы ISAv не дали положительных результатов теста на жизнеспособные ISAv при культуре ткани или показали клинические признаки ISA.
Поселение вшей и экспрессия родственных генов
В этом исследовании был достигнут высокий уровень заражения вшами, начиная с примерно 60–80 сидячих халимусов при отборе проб до ISAv и до 50 подвижных вшей после добавления рыбы-прыгуна. Однако уровень заражения вшами резко снизился через 16 дней после контакта с рыбой-шедером ISAv +. Коинфекция вшей и ISAv индуцировала воспалительные гены и гены ремоделирования тканей IL-1 и MMP 9 на протяжении всего исследования.Лосось штамма Пенобскот имел значительно более высокие уровни экспрессии IL-1β на 17 дней в день для морских вшей, то есть до воздействия ISAv, чем у трех объединенных семей реки Сент-Джон, тогда как обратное было верно для морских вшей при 21 день на день, что позволяет предположить Три комбинированных семейства штамма Penobscot были способны вызывать воспалительную реакцию на морских вшей быстрее, чем три комбинированных семейства штамма Saint John.
Такой же паттерн экспрессии подтвердился при исследовании экспрессии гена MMP 9, который использовался в качестве индикатора для оценки реакции заживления ран рыб на заражение морскими вшами. Разработка, применение и проверка RT-PCR Taqman® в реальном времени. тест на выявление вируса инфекционной анемии лосося [48, 49].Опять же, штамм Penobscot имел значительно более высокие уровни экспрессии MMP 9, на этот раз на 34 d.p.e для морских вшей, чем три комбинированных семейства протестированных штаммов Saint John. Задержка в повышении регуляции MMP9 по отношению к IL-1 ожидается, поскольку повторное моделирование ткани и заживление ран находятся ниже по течению в инициировании воспалительной реакции и наблюдались при других инфекциях вшей у лосося [48, 49]. По всей видимости, это не привело к снижению нагрузки вшами на рыб этих семейств.Оказалось ли это какое-либо влияние на более высокую выживаемость этих рыб из комбинированных семейств, полученных из Пенобскота, испытанных по сравнению с семьями Сент-Джон, испытанными после воздействия ISAv, нельзя полностью распутать из-за большей присущей штамму Пенобскот устойчивости по сравнению с штаммом реки Сент-Джон. против ISAv, поскольку штамм Penobscot имел более высокую выживаемость, чем штамм Saint John River в обоих условиях, и демонстрировал параллельное повышение чувствительности к ISAv на основе воздействия на вшей.Это наблюдение можно объяснить тем, что рыбы, которые стимулируют воспаление и заживляют раны, могут быстрее заживлять раны, вызванные вшами. Более быстро заживающие раны предотвращают проникновение ISAv в организм хозяина так же легко, как у рыб с открытыми ранами в эпидермисе. Такая модель для MMP 9 была предложена несколькими группами [22, 48–50] как возможный механизм устойчивости атлантического лосося к морским вшам [51, 52].
Экспрессия гена, связанного с ISAv
Mx представляет собой индуцированный интерфероном противовирусный белок, и было обнаружено, что ISAv вызывает сильный ответ Mx как in vitro, так и in vivo [53, 54].Однако, несмотря на то, что индуцируются ключевые белки, индуцированные интерфероном I типа, такие как Mx, они не считаются защитными и неспособными ингибировать репликацию ISAv ни in vitro, ни in vivo [53, 54]. Экспрессия гена Mx1 указывает на воздействие ISAv и обычно активируется у позвоночных при воздействии ортомиксовирусов (часть «пути гриппа» [55, 56], но не указывает на соответствующий иммунный ответ ISAv [53, 54, 57, 58]). , а также может наблюдаться влияние других вирусных или внутриклеточных бактериальных инфекций [59–61].В этом исследовании было обнаружено, что экспрессия Mx1 была значительно подавлена в группе, подвергшейся воздействию вшей, на 17 день (т.е. непосредственно перед воздействием ISAv) по сравнению с контрольной группой. Полученные данные могут указывать на то, что воздействие инфекции морскими вшами до вирусной инфекции препятствует способности рыб распознавать последующее воздействие ISAv / внутриклеточных патогенов.
В 37 дней в день для сожительствующих рыб, инфицированных ISAv, группа со вшами и ISAv имела значительно более высокую экспрессию Mx1, чем только ISAv и контрольная группа, что свидетельствует об отсроченном иммунном ответе на воздействие ISAv у двух инфицированных рыб, поскольку энергия была снижена. также используется для создания антипаразитарного ответа на заражение вшами.В группе вшей плюс ISAv при 37 d.p.e. по данным ISAv, на данный момент осталось только три рыбы из-за высокой специфической смертности ISAv в группах с двойным заражением. Отсюда любые выводы, сделанные на 37 д.п.в. к ISAv в этой группе лечения следует применять с осторожностью.
Когда группы обработки были разделены на две группы происхождения (Penobscot и Saint John), было обнаружено, что в трех комбинированных семьях рыб, полученных из Saint John, подвергшихся воздействию ISAv при 3 dpe, был значительно более высокий уровень экспрессии Mx1, чем это наблюдали в трех комбинированных семейств протестированных штаммов Penobscot.Это может означать, что эти комбинированные семьи происхождения Сент-Джона более способны к раннему распознаванию ISAv, чем исследованные комбинированные семьи происхождения Пенобскота. Однако следует помнить, что повышающая регуляция Mx1 не является защитной [58, 62] и не ингибирует репликацию ISAv [58, 62]. Также было обнаружено, что три комбинированные протестированные семьи Сент-Джон обладали значительно более низкой выживаемостью после воздействия ISAv независимо от того, присутствовало ли предшествующее заражение вшами или нет (p = 0,0211 и p = 0,0309, соответственно).Эти данные свидетельствуют о том, что три комбинированных семейства протестированных особей Saint John были более восприимчивы к смертности из-за ISAv и что повышающая регуляция Mx1, наблюдаемая у этих рыб при 3 dpe к ISAv, не была защитной, как показано в предыдущих исследованиях [ 53, 54]. По-прежнему наблюдался значительно более низкий уровень выживаемости в стадах Сент-Джон и Пенобскот, подвергшихся воздействию L . salmonis до воздействия ISAv по сравнению с рыбами, подвергшимися только воздействию ISAv (p <0.0001 для обоих).
Например, известно, что количество провоспалительных генов, таких как IL-1, увеличивается из-за инфекции ISAv, а в некоторых случаях снижается при инфекциях лосося. Другие гены, такие как гены MH класса I, галектина, TRIM, Mx, все чувствительны к вирусной инфекции. Поскольку IL-1 может по-разному регулироваться с помощью ISAv или Lsal, при коинфекции мы можем ожидать любое направление экспрессии. Кроме того, поскольку рыба умирает и может быть близка к смерти, часто встречается дисрегулатин гена, и в это время реакции могут не функционировать.
ЭкспрессияMHC1-β была значительно подавлена в группах, зараженных вшами, на -1, 3 и 16 день после введения ISAv. Не наблюдалось увеличения экспрессии MHC1-β в группе, зараженной вшами, до 55 dpe для вшей и 37 dpe для ISAv. Это может указывать на то, что предшествующее заражение вшами снижает способность рыб создавать ответ MHC1-β на воздействие ISAv. MHC1 участвует во внутриклеточной презентации антигена, например вирусные пептиды на поверхности инфицированных клеток. Любое подавление экспрессии MHC1-ß на ранней стадии инфекции может снизить эффективность презентации антигена и активации Т-клеток.Jorgensen et al. [63] предполагают, что CD8 + Т-клетки, которые распознают вирусные мишени путем связывания с вирусными антигенами, ассоциированными с MHC класса I на инфицированных клетках, важны во время ранней виремии ISAv по сравнению с CD4 + Т-клетками. Гены, выбранные для анализа, были основаны на литературе по морским вшам и ISAv. Подавление экспрессии гена MHC1-ß соответствует подавлению экспрессии белка MHC1-ß. Этот процесс также может повлиять на презентацию антигена у рыб, инфицированных ISAv и морскими вшами, но для подтверждения этого потребуется дополнительное тестирование.Не было значительных различий в уровнях экспрессии MHC1-β между акциями Penobscot и St John в любой из выбранных временных точек.
Уровни экспрессии генов галектина 9, TRIM 16 и TRIM 25 использовали в качестве меры противовирусного ответа хозяина. Галектин-9 представляет собой растворимый лектин, не связанный с мембраной, который активируется во время ISAv-инфекции клеток ASK in vitro [64] и, как полагают, играет роль в регуляции разнообразного набора иммунных функций [65]. Schiotz et al.[66] также наблюдали повышающую регуляцию галектин-подобных генов после инфекции ISAv in vitro и заявили, что это явная особенность инфекции ISAv in vitro. Известно, что члены семейства трехчастичных белков, содержащих мотив (TRIM), такие как TRIM 16 и TRIM 25, активируются через 3, 7 и 16 дней после инфицирования ISAv у лосося [62], и хотя их точные функции у рыб неизвестны, они предполагается, что они играют роль в модуляции фундаментальных врожденных противовирусных иммунных ответов. Например, Gack et al [67] и LeBlanc [68] et al предположили, что TRIM 25 участвует в продукции IFN-β, а другой TRIM, называемый TRIM 5α, как было обнаружено, мешает репликации ВИЧ-1 у приматов [69].Паттерн экспрессии всех трех генов, галектина-9, TRIM 16 и TRIM 25, был сходным для разных групп и временных точек. Как при предварительном воздействии, так и при 3 dpe для ISAv, группы, зараженные вшами, показали подавление экспрессии антивирусных генов по сравнению с контрольной группой и группами только с ISAv. К 16 dpe к ISAv уровень галектина 9 в группах, инфицированных вшами плюс ISAv, вернулся к уровням, аналогичным уровням в контроле и в группах только с ISAv. Этот паттерн также наблюдался для экспрессии гена TRIM 16. Эти результаты позволяют предположить, что предшествующее заражение морскими вшами снижает способность рыб вызывать соответствующий ранний противовирусный ответ на последующее воздействие ISAv.Единственное различие в отношении характера экспрессии гена TRIM 25 состояло в том, что группа, зараженная вшами, продолжала демонстрировать более низкую экспрессию гена при 16 dpe для ISAv по сравнению как с контрольной группой, так и с группой только с ISAv.
Связь с инфекциями ISAv в сельскохозяйственных популяциях атлантического лосося
Заражение морскими вшами обычно происходит вскоре после их попадания в морские районы Восточной Канады и США. В то время как вспышки ISAv часто происходят гораздо дольше.Например, статьи Hammell и Dohoo [70,71] (2005ab) показали, что риск смертности от ISAv увеличивался из-за присутствия морских вшей, а McClure et al (2005) [72] также показали, что значительные факторы риска ISAv вспышки связаны с количеством обработок лосося от морских вшей. Наконец, присутствие ISAv на ферме часто требует депопуляции инфицированной клетки, и поэтому расследование заражения вшами после воздействия ISAv не имело никакого смысла с точки зрения применения в полевых условиях.Что касается уровней зараженности, рецензенты руководствуются данными из отчетов Ассоциации рыбоводов атлантического лосося (ACFFA) для залива Фанди (BoF) в Канаде за период с 2010 года по настоящее время. Уровни зараженности в BoF часто достигают 5–10 взрослых самок на рыбу и в некоторых случаях> 20 взрослых самок на рыбу. Данные по взрослым самцам, предварительным взрослым и стадиям халимуса в этих отчетах не приводятся, но соотношение полов всегда близко к 50:50, а количество других стадий обычно выше, чем у взрослых самок, за исключением зимних сезонов.Мы выбрали уровень заражения, который находился в том же диапазоне, что и BoF в Канаде.
Морские вши | Институт морских исследований
Три рыбьи вши, обычно встречающиеся в норвежских водах: тресковые вши ( Caligus curtus ) слева (самки и самцы), лососевые вши (самки и самцы) и Caligus elongatus (самки с яйцами и самцы). ). В случае тресковых вшей самец является самым крупным, в то время как у двух других видов особи самок крупнее.
Фото: Ларс ХамреУ лососевых вошей есть два «родственника», которых можно найти на нелососевых рыбах.
Опубликовано: 17.12.2018 Обновлено: 07.07.2021
Многие рыбы могут быть заражены вшами, которые в целом можно назвать рыбьими вшами.Некоторые виды рыбных вшей зависят от вида и встречаются только у одного или нескольких видов рыб. Примером этого является лососевая вошь, которая поражает только рыбу из семейства лососевых (лососевых). В Норвегии это атлантический лосось, морская форель и арктический голец, а также разводимая радужная форель.
Похоже на лососевую вошь
Подобно лососевым вшам, которые встречаются только на лососевых рыбах, тресковые вши встречаются только на рыбах из семейства тресковых.
Тресковые вши на треске. Взрослая самка с яйцами.На фото также есть еще одна вошь гораздо меньшего размера, чуть ниже тресковой. Эта вошь является более мелкой стадией и не была идентифицирована по видам. Фотограф Бьёрнар Скьолд / IMR.Эти вши выглядят относительно похожими (сравните это изображение с изображением всех трех видов вшей вверху), и глядя на хозяина рыбы, вы часто можете определить вид вшей. Если вы хотите быть уверенным в том, какой у вас вид вшей, вам следует делать качественные снимки, желательно взрослых особей обоих полов.Не забудьте указать что-нибудь, чтобы указать размер. В качестве альтернативы, животное должно быть собрано на спирте, а вид должен быть определен молекулярными методами.
Caligus elongatus не разборчив в едеНо есть и рыбные вши, которые не так разборчивы в выборе рыбных хозяев. Примером этого является рыбная вошь, Caligus elongatus (на норвежском языке известная как «шотландская вошь»), которая была обнаружена у многих различных видов рыб, включая люмпсак, сельдь, мойву, а также у рыб из семейств тресковых и лососевых. .
Caligus elongatus меньше, чем лососевая вошь и тресковая вошь, и чаще встречается в северной Норвегии. Caligus elongatus также ведет себя иначе, чем лососевая вошь, и часто наблюдается переход от одной рыбы к другой.
Например, выращиваемая рыба может подвергнуться значительному переносу Caligus elongatus из дикой рыбы, когда косяки сельди или мойвы проходят мимо фермерских участков.
Что такое морские вши и как их избежать на пляже?
Вы упаковали пляжную сумку и облачились в купальник, и ваш мозг полон счастливых мыслей о развлечениях на солнце.Вы не можете дождаться , чтобы нырнуть в океан и почувствовать соленую воду на своей коже, верно? Хотя это все здорово и весело, вам следует помнить, что купание в песке и море также сопряжено с определенными рисками.
Одна из этих опасностей? Существо с неприятным звуком, называемое морскими вшами, которые проникают в купальники пляжников и вызывают красную неровную сыпь, называемую извержением морского купца .
Если вы не хотите, чтобы это был , прочтите советы, как избежать высыпаний на пляже.
Что такое морские вши?Этих ребят не следует путать с головными вшами. Несмотря на похожее название, морские вши совсем не похожи на этих крошечных насекомых, которые любят жить в ваших волосах и вызывать зуд в голове. На самом деле это вовсе не вши, поэтому название вводит в заблуждение.
«Морские вши» на самом деле относятся к типу крошечных медуз, а также к определенному виду морского анемона. (Их также не следует путать с , паразитом под названием «морские вши» , который любит цепляться за лосося, но не поражает людей.)
Личиночные стадии наперсточной медузы и разновидности морского анемона, называемого Edwardsiella lineata , настолько крошечные, что люди даже не замечают, когда плавают в их бассейне. «Было описано, что эти организмы размером с перчинку и полупрозрачны, поэтому их невозможно избежать в воде», — говорит Эллисон Артур, доктор медицинских наук , сертифицированный дерматолог из Орландо, Флорида.
Медуза и морской анемон выделяют яд, когда чувствуют угрозу.Если вы просто плаваете вокруг них, то, скорее всего, все будет в порядке. Но эти существа настолько малы, что могут попасть внутрь вашего купального костюма, отмечает доктор Артур. Затем, когда вы вылезаете из воды и шлепаетесь на пляжное полотенце, эти твари реагируют и кусают вас (и, действительно, кто может их винить?).
Какой самый распространенный симптом морских вшей?Если вас ужалили, вы узнаете примерно через 24 часа после того, как отправились купаться в океане. Яд вызывает «реакцию гиперчувствительности».Артур описывает — и реакция проявляется в виде красных зудящих прыщиков на коже. Обычно вы видите эти неровности на участках, которые были прикрыты купальным костюмом, где были пойманы личинки медузы или морского анемона. Но у некоторых людей также может появиться сыпь в местах, где возникает трение, , например, там, где трутся ваши бедра.
По словам доктора Артура, морская сыпь обычно держится от одной до двух недель. В очень редких случаях это может сопровождаться другими симптомами, такими как жар, тошнота, диарея или головная боль.
Не волнуйтесь: сыпь может раздражать, но обычно не опасна. По словам доктора Артура, легкие случаи можно лечить с помощью безрецептурных кремов с гидрокортизоном и антигистаминных таблеток. Но она рекомендует обратиться к врачу, если у вас действительно есть такие симптомы, как жар и головная боль, чтобы убедиться, что вы не имеете дело с какой-либо другой проблемой со здоровьем, которая может быть причиной ваших симптомов.
Есть несколько шагов, которые можно предпринять, чтобы избежать проблемы с морскими вшами.Учитывая, что морские вши в основном невидимы, может показаться, что вы ничего не можете сделать, чтобы защитить себя (кроме как избегать океана!).Но даже простая проверка местных отчетов об океане может держать вас в курсе о морских вшах — и при необходимости вы можете держаться подальше от воды.
Например, по данным Министерства здравоохранения Флориды , личинки наперсточной медузы сносятся в воды Флориды и ручьи залива с конца весны до лета. Более того, вспышки сыпи, вызванной морскими вшами, часто регистрируются в Карибском бассейне, Мексике, Бразилии, Филиппинах и Флориде. Редкие случаи также выявлены на северо-востоке США.Артур отмечает.
Итак, плавайте в этих местах на свой страх и риск и следите за сообщениями о вспышках, добавляет она. Если другие люди сообщали о высыпаниях после купания, скорее всего, на общественных сайтах и досках объявлений появятся новости или сообщения о вспышках извержения морского дна. И, может быть, ты хочешь пропустить в тот день пляж и вместо этого устроить вечеринку у бассейна.
Если вы все же решите пойти поплавать или если сообщений нет, но вы все равно хотите соблюдать осторожность, возьмите с собой на пляж смену нижнего белья.Доктор Артур советует вам как можно скорее снять купальный костюм и промыть кожу пресной водой, чтобы избавиться от морских вшей. Чем меньше шансов у этих существ укусить, тем лучше.
Этот контент импортирован из {embed-name}. Вы можете найти тот же контент в другом формате или найти дополнительную информацию на их веб-сайте.
Вернувшись домой, постирайте купальный костюм с моющим средством в стиральной машине, а затем просушите его в сушилке, если сможете.«Тепло может помочь убить любые оставшиеся организмы, застрявшие в ткани», — говорит доктор Артур. Она слышала о некоторых случаях, когда у человека, у которого была морская сыпь, после того, как он просто сполоснул купальный костюм и дал ему высохнуть. Затем, после того, как их первая сыпь зажила, они надели купальник, и сыпь снова появилась. Не весело.
Если у вас все-таки появилась сыпь от морских вшей, вы можете просто выбросить свой костюм. «В тяжелых случаях извержения морского волка вы также можете подумать о том, чтобы выбросить зараженный купальный костюм», — сказал д-р.Артур говорит, что, поскольку костюм , возможно, все еще несет крошечные медузы и морской анемон. Вы действительно не хотите рисковать.
Несмотря ни на что, постарайтесь не позволить страху перед морскими вшами разрушить ваши летние планы. Множество людей каждый год наслаждается пляжем без сыпи. А если вам не повезло, что вас ужалили, вы можете легко обработать шишки небольшим количеством крема из аптеки.
Этот контент создается и поддерживается третьей стороной и импортируется на эту страницу, чтобы помочь пользователям указать свои адреса электронной почты.Вы можете найти больше информации об этом и подобном контенте на сайте piano.io.
Заражение рыб морскими вшами (Caligidae)
Ахмед Мустафа, Мак-Вильямс К., Фернандес Н., Матчетт К., Конбой Г. А., Бурка Дж. Ф., 2000. Влияние заражения морскими вшами (Lepeophtheirus salmonis Kröyer, 1837) на функции макрофагов атлантического лосося (Salmo salar L.). Иммунология рыб и моллюсков, 10 (1): 47-59
Alderman DJ, 2002. Тенденции в терапии и профилактике 1991-2001 гг.Бюллетень Европейской ассоциации патологов рыб, 22 (2): 117-125
Berland B, 1983. Присутствие изоподы Cirolana borealis и амфиподы Tmetonyx cicada в икрах трески (Gadus morhua) и сайды (Pollachius virens). ). Fiskers Gang, 6/7: 175-179 (аннотация)
Bjordal A, 1988. Чистящий симбиоз между губанами (Labridae) и лососем, зараженным вшами (Salmo salar) в марикультуре. Международный совет по исследованию моря, C.M.F, 17: 1-8
Bjordal A, 1990.Губан как рыба-чистильщик для выращиваемого лосося. Progress in Underwater Science, 16: 17-28
Bowers JM, Mustafa A, Speare DJ, Conboy GA, Brimacombe M, Sims DE, Burka JF, 2000. Физиологическая реакция атлантического лосося, Salmo salar L., на сингл экспериментальное заражение морскими вшами, Lepeophtheirus salmonis. Journal of Fish Diseases, 23 (3): 165-172
Boxshall GA, 1974. Инфекции паразитических веслоногих рачков у морских рыб Северного моря. Журнал Морской биологической ассоциации, Великобритания, 54: 355-372
Boxshall GA, 1974.Популяционная динамика Lepeophtheirus pectoralis (Muller): сезонные колебания численности и возрастной структуры. Parasitology, 69: 361-371
Boxshall GA, 1976. Специфичность хозяина Lepeophtheirus pectoralis (Muller, 1776) (Copepoda: Caligidae). Journal of Fish Biology, 8: 255-264
Boxshall GA, 1977. Гистопатология инфекции Lepeophtheirus pectoralis (Muller) (Copepoda: Caligidae). Журнал биологии рыб, 10 (4): 411-415; [5 л.]
Брандал П.О., Эгидиус Э., 1977.Предварительный отчет о пероральном лечении от лососевых вшей, Lepeophtheirus salmonis, с помощью Neguvon. Аквакультура, 16 (2): 177-178
Bravo S, 2003. Морские вши на чилийских лососевых фермах. Бюллетень Европейской ассоциации патологов рыб, 23 (4): 197-200
Bron JE, Sommerville C, Jones M, Rae GH, 1991. Расселение и прикрепление лососевых вшей на ранних стадиях, Lepeophtheirus salmonis (Copepoda: Caligidae) на лососевом хозяине, Salmo salar. Журнал зоологии, 224: 201-212
Bron JE, Sommerville C, Rae GH, 1993.Аспекты поведения личинок веслоногих лососевых вшей Lepeophtheirus salmonis (Kryer, 1837). В: Boxshall GA, Defaye D, eds. Возбудители диких и выращиваемых рыб: морские вши. Нью-Йорк, США: Ellis Horwood, 125-142
Bron JE, Treasurer JW, 1992. Морские вши (Caligidae) на губах (Labridae) из избранных британских источников диких животных и лососевых ферм. Журнал Морской биологической ассоциации Соединенного Королевства, 72 (3): 645-650
Bruno DW, Stone J, 1990. Роль сайды, Pollachius virens L., как хозяин морских вшей, Lepeophtheirus salmonis Kryer и Caligus elongatus Nordmann. Аквакультура, 89 (3/4): 201-207
Барреллс К., Уильямс П.Д., Форно П.Ф., 2001. Пищевые нуклеотиды: новая добавка в корма для рыб. 1. Влияние на устойчивость лососевых к болезням. Аквакультура, 199 (1/2): 159-169
Burridge LE, Hamilton N, Waddy SL, Haya K, Mercer SM, Greenhalgh R, Tauber R, Radecki SV, Crouch LS, Wislocki PG, Endris RG, 2004. Acute токсичность бензоата эмамектина (SLICE) в корме для американского лобстера, Homarus americanus.Aquaculture Research, 35: 713-722
Byrnes T., Rohde K, 1992. Географическое распространение и специфичность хозяев эктопаразитов австралийского леща, Acanthopagrus spp. (Sparidae). Folia Parasitologica, 39 (3): 249-264
Costello M, Bjordal Å, 1990. Насколько хорош этот естественный контроль морских вшей ?. Рыбовод, 13 (3): 44..46
Костелло М., Боксхолл В, 2000. От редакции. Aquaculture Research, 31: 793-794
Davies IM, Rodger GK, 2000. Обзор использования ивермектина для лечения заражения морских вшей [Lepeophtheirus salmonis (Kryer) и Caligus elongatus Nordmann] у выращиваемого атлантического лосося (Salmo salar) Л.). Исследования аквакультуры, 31 (11): 869-883
Egidius E, 1985. Лососевые вши, Lepeophtheirus salmonis. Journal of Animal Morphology and Physiology, 26: 1-4
Fallang A, Ramsay JM, Sevatdal S, Burka JF, Jewess P, Hamell KL, Horsberg TE, 2004. Доказательства наличия в штаммах фосфорорганического типа ацетилхолинэстеразы морских вшей (Lepeophtheirus salmonis Kroyer). Наука о борьбе с вредителями, 60 (12): 1163-1170
Fast MD, Burka JF, Johnson SC, Ross NW, 2003.Ферменты, выделяемые Lepeophtheirus salmonis в ответ на слизь различных лососевых. Journal of Parasitology, 89 (1): 7-13
Fast MD, Ross NW, Craft CA, Locke SJ, MacKinnon SL, Johnson SC, 2004. Lepeophtheirus salmonis: характеристика простагландина E2 в секреторных продуктах лососевой вши с помощью RP -ВЭЖХ и масс-спектрометрия. Experimental Parasitology, 107: 5-13
Fraile L, 1986. Экспериментальная демонстрация привлекательности копепода и взрослых стадий паразита Caligus minimus (Copepoda: Caligidae) для окуня Dicentrarchus labrax (Teleostei, Serranidae).European Aquaculture, Society, Special Publication, 9: 185 (аннотация)
Frerichs GN, Millar SD, McManus C, 1992. Атипичная Aeromonas salmonicida, выделенная из здорового губана (Ctenolabrus rupestris). Бюллетень Европейской ассоциации патологов рыб, 12 (2): 48-49
Fujita S, Yoda M, Ugajin I, 1968. Контроль над эктопаразитической копеподой Caligus spinosus Yamaguti на выращиваемой взрослой желтохвосте. Патология рыб, 2: 122-127
Гловер К.А., Хамре Л.А., Скаала О., Нильсен Ф., 2004.Сравнение уровней заражения морской вшей (Lepeophtheirus salmonis) в стадах выращиваемого и дикого атлантического лосося (Salmo salar L.). Аквакультура, 232 (1/4): 41-52
Грант А.Н., казначей Дж. У., 1993. Влияние пара на заражение калигадов выращиваемого атлантического лосося (Salmo salar L.) в Шотландии. В: Boxshall GA, DeFaye D, eds. Возбудители диких и выращиваемых рыб: морские вши. Нью-Йорк, США: Ellis Horwood, 255-260
Grayson TH, Jenkins PG, Wrathmell AB, Harris JE, 1991. Сывороточные реакции на лососевую вошь, Lepeophtheirus salmonis (Kroyer, 1838), у естественно инфицированных лососевых и иммунизированной радужной форели. , Onchorhynchus mykiss (Walbaum) и кролики.Иммунология рыб и моллюсков, 1 (2): 141-155
Grayson TH, John RJ, Wadsworth S, Greaves K, Cox D, Roper J, Wrathmell AB, Gilpin ML, Harris JE, 1995. Иммунизация атлантического лосося против лососевая вошь: определение антигенов и влияние на плодовитость вшей. Journal of Fish Biology, 47 (SUPPA): 85-94
Hastein T., Bergsjo T, 1976. Вши лосося Lepeophtheirus salmonis как причина болезней разводимых лососевых. Revista Italiana Piscicoltura e Ittiopatologia, II: 3-5
Heuch P, Revie C, Gettinby G, 2003.Сравнение эпидемиологических моделей лососевых вшей, Lepeophtheirus salmonis, инфекций атлантического лосося, выращиваемого на фермах, Salmo salar L., в Норвегии и Шотландии. Журнал Морской биологической ассоциации Соединенного Королевства, 75: 927-939
Heuch PA, Parsons A, Boxaspen K, 1995. Вертикальная миграция Диль: возможный механизм поиска хозяина у копеподид лососевых вошей (Lepeophtheirus salmonis) ?. Канадский журнал рыболовства и водных наук, 52 (4): 681-689
Hewitt GC, 1971.Два вида Caligus (Copepoda, Caligidae) из австралийских вод с описанием некоторых стадий развития. Pacific Science, 25: 145-164
Ho JS, 2000. Основная проблема садковой аквакультуры в Азии связана с морскими вшами. В: Liao I, Lin C, eds. Садковая аквакультура в Азии, Труды Первого международного симпозиума по садковой аквакультуре в Азии. Азиатское рыболовное общество, Манила и Всемирное общество аквакультуры, отделение в Юго-Восточной Азии, Бангкок, стр. 13-19
Hogans WE, Trudeau DJ, 1989.Caligus elongatus (Copepoda: Caligoida) из атлантического лосося (Salmo salar), выращиваемого в морских водах нижней части залива Фанди. Canadian Journal of Zoology, 67 (4): 1080-1087
Hogans WE, Trudeau DJ, 1989. Предварительные исследования биологии морских вшей, Caligus elongatus, Caligus curtus и Lepeophtheirus salmonis (Copepoda: Caligoida), паразитирующих при выращивании в клетках. лососевые в нижней части залива Фанди. Канадский технический отчет по рыболовству и водным наукам, № 1715: iv + 14pp
Hotta H, 1962.Паразитизм сайры (Cololabis saira), зараженной паразитическими Copepoda, Caligus macarovi Gussev, во время промыслового сезона 1961 года. Бюллетень Региональной научно-исследовательской лаборатории рыболовства Тохоку, 21: 50-56
Hoy T, Horsberg TE, Nafstad I, 1992. Распределение ивермектина в атлантическом лососе (Salmo solar). В: Michel C, Alderman DJ, ред. Химиотерапия в аквакультуре: от теории к реальности. Париж, Франция: Office International des Epizooties, 461-467
Hwa TK, 1965. Исследования жизненного цикла рыбной воши (Caligus orientalis Gussev).Acta Zoologica Sinica, 17: 48-63
Ingvarsdóttir A, Birkett MA, Duce I, Genna RL, Mordue W., Pickett JA, Wadhams LJ, Mordue AJ, 2002. Семиохимические стратегии борьбы с морскими вошами: подсказки местоположения хозяина. Наука о борьбе с вредителями, 58 (6): 537-545
Johnson SC, 1998. Паразиты ракообразных. В: Kent ML, Poppe TT, eds. Болезни лососевых рыб, выращенных в морской воде. Британская Колумбия, Канада: Тихоокеанская биологическая станция рыболовства и океанов Канада, 80-90
Johnson SC, Albright LJ, 1991.Развитие, рост и выживаемость Lepeophtheirus salmonis (Copepoda: Caligidae) в лабораторных условиях. Журнал Морской биологической ассоциации Соединенного Королевства, 71 (2): 425-436
Johnson SC, Albright LJ, 1992. Сравнительная чувствительность и гистопатология реакции атлантического лосося, чавычи и кижуча на экспериментальную инфекцию Lepeophtheirus salmonis. (Копеподы: Caligidae). Болезни водных организмов, 14 (3): 179-193
Johnson SC, Albright LJ, 1992.Влияние имплантатов кортизола на чувствительность и гистопатологию ответов наивного кижуча Oncorhynchus kisutch на экспериментальную инфекцию Lepeophtheirus salmonis (Copepoda: Caligidae). Болезни водных организмов, 14 (3): 195-205
Johnson SC, Constible JM, Richard J, 1993. Лабораторные исследования эффективности перекиси водорода против лососевых вшей Lepeophtheirus salmonis и его токсикологического и гистопатологического воздействия на атлантического лосося. салар и чавыч Oncorhynchus tshawytscha.Болезни водных организмов, 17 (3): 197-204
Jones JB, 1980. Переописание Caligus patulus Wilson, 1937 (Copepoda, Caligidae) с рыбной фермы на Филиппинах. Systematic Parasitology, 2: 103-116
Jones MW, Sommerville C, Bron J, 1990. Гистопатология, связанная с ювенильными стадиями Lepeophtheirus salmonis атлантического лосося, Salmo salar L. Journal of Fish Diseases, 13 (4): 303-310
Jones MW, Sommerville C, Wootten R, 1992. Пониженная чувствительность лососевых вошей Lepeophtheirus salmonis к органофосфат дихлофосу.Journal of Fish Diseases, 15 (2): 197-202
Jónsdóttir H, Bron JE, Wootten R, Turnbull JF, 1992. Гистопатология, связанная с до-взрослой и взрослой стадиями Lepeophtheirus salmonis на атлантическом лососе, Salmo salar L. Journal of Fish Diseases, 15 (6): 521-527
Kabata Z, 1979. Паразитические веслоногие рачки британских рыб. Лондон, Великобритания: Британский музей (естественная история)., 468pp.
Kabata Z, Hewitt GC, 1971. Двигательные механизмы у Caligidae (Crustacea: Copepoda). Журнал Совета по исследованиям рыболовства Канады, 28: 1143-1151
Landsberg JH, Vermeer GK, Richards SA, Perry N, 1991.Борьба с паразитической копеподой Caligus elongatus на выращиваемом в пруду красном барабане. Journal of Aquatic Animal Health, 3 (3): 206-209
Lavina EM, 1977 г. Биология и борьба с Caligus sp., Эктопаразитом взрослой молочной рыбы Chanos chanos Forskal. Ежеквартальный исследовательский отчет SEAFDEC. Филиппины: Департамент аквакультуры SEAFDEC 1977, 12-13
Lester RJG, Roubal FR, 1995. Phylum Arthropoda. В: Ву ПТК, под ред. Болезни и расстройства рыб. Том 1: инфекции простейшими и многоклеточными. Уоллингфорд, Великобритания: CAB International, 475-598
Lin CL, Ho JS, 1993.Жизненный цикл Caligus epidemicus Hewitt, паразитирующий на тилапии (Oreochromis mossambicus), культивируемой в солоноватой воде. В: Boxshall GA, DeFaye D, eds. Возбудители диких и выращиваемых рыб: морские вши. Нью-Йорк, США: Эллис Хорвуд, 5-15
Lin CL, Ho JS, Chen SN, 1994. Два вида Caligus (Copepoda: Caligidae) паразитируют на черноморском леще (Acanthopagrus schlegeli), выращиваемом на Тайване. Gyobyo Kenkyu = Fish Pathology, 29 (4): 253-264
MacKenzie K, Morrison JA, 1989. Необычно сильное заражение сельди (Clupea harengus L.) с паразитической копеподой Caligus elongatus Nordmann, 1832. Бюллетень Европейской ассоциации патологов рыб, 9 (1): 12-13
MacKinnon BM, 1991. Морские вши и атлантический лосось: отсутствие иммунной защиты у Salmo salar до Caligus elongatus .. Бюллетень Ассоциации аквакультуры Канады, № 3: 58-60
Mann H, 1970. Copepoda и Isopoda как паразиты морских рыб. В: Snieszko S, ed. Симпозиум по болезням рыб и моллюсков. Специальная публикация 5. Вашингтон, США: Американское рыболовное общество, 177–189
МакЭндрю К.Дж., Соммервилл К., Вуттен Р., Брон Дж. Э., 1998.Влияние обработки перекисью водорода на различные стадии жизненного цикла лососевых вшей, Lepeophtheirus salmonis (Kryer, 1837). Journal of Fish Diseases, 21 (3): 221-228
Meeus Tde, Renaud F, Gabrion C, 1990. Модель для изучения механизмов изоляции в популяциях паразитов: род Lepeophtheirus (Copepoda, Caligidae). Journal of Experimental Zoology, 254 (2): 207-214
Mustafa A, Speare DJ, Daley J, Conboy GA, Burka JF, 2000. Повышенная восприимчивость выращиваемой в морской воде радужной форели Oncorhynchus mykiss (Walbaum) к микроспоридийным ломам. salmonae во время первичного заражения морской вшей Lepeophtheirus salmonis.Journal of Fish Diseases, 23 (5): 337-341
Nagasawa K, 1987. Распространенность и численность Lepeophtheirus salmonis (Copepoda: Caligidae) на лососе и форели в открытом море в северной части Тихого океана. Nippon Suisan Gakkaishi (Бюллетень Японского общества научного рыболовства), 53 (12): 2151-2156
Nagasawa K, 2004. Морские вши, Lepeophtheirus salmonis и Caligus orientalis (Copepoda: Caligidae), диких и выращиваемых в море рыб. и солоноватые воды Японии и прилегающих регионов: обзор.Zoological Studies, 43: 173-178
Nagasawa K, Ishida Y, Ogura M, Tadokoro K, Hiramatsu K, 1993. Численность и распространение Lepeophtheirus salmonis (Copepoda: Caligidae) на шести видах тихоокеанских лососей в прибрежных водах север Тихого океана и Берингова моря. В: Boxshall GA, DeFaye D, eds. Возбудители диких и выращиваемых рыб: морские вши. Нью-Йорк, США: Ellis Horwood, 166-178
Nylund A, Bjrknes B, Wallace C, 1991. Lepeophtheirus salmonis — возможный переносчик болезней на лососевых.Бюллетень Европейской ассоциации патологов рыб, 11 (6): 213-216
Nylund A, Okland S, Bjrknes B, 1992. Анатомия и ультраструктура пищеварительного тракта у Lepeophtheirus salmonis (Copepoda: Siphonostomatoida). Journal of Crustacean Biology, 12 (3): 423-437
Nylund A, Wallace C, Hovland T, 1993. Возможная роль Lepeophtheirus salmonis (Kryer) в передаче инфекционной анемии лосося. В: Boxshall GA, Defaye D, eds. Возбудители диких и выращиваемых рыб: морские вши.Лондон, Великобритания: Ellis Horwood Ltd, 367-373
Palmer R, Rodger H, Drinan E, Dwyer C, Smith PR, 1987. Предварительные испытания эффективности ивермектина против паразитических копепод атлантического лосося. Бюллетень Европейской ассоциации патологов рыб, 7 (2): 47-54
Паперна I, Лахав М., 1974. Смертность кефалей в водоеме с морской водой из-за эпизоотии калигиидных паразитических копепод. Bamidgeh, 26: 12-15
Parker RR, 1969. Достоверность биномена Caligus elongatus для обычного паразитического копепода, ранее ошибочно идентифицированного с Caligus rapax.Журнал Совета по исследованиям рыболовства Канады, 26: 1013-1035
Паркер Р.Р., Марголис Л., 1964. Новый вид паразитических копепод, Caligus clemensi sp. novo (Caligoida, Caligidae) из пелагических рыб прибрежных вод Британской Колумбии. Журнал Совета по исследованиям рыболовства Канады, 21: 873-889
Pike AW, 1989. Морские вши — основные патогены атлантического лосося, выращиваемого на фермах. Parasitology Today, 5 (9): 291-297
Pike AW, Wadsworth SL, 1999. Морские котики на лососевых: их биология и меры борьбы.Успехи в паразитологии, 44: 233-337
Радхакришнан С., Наир Н.Б., 1981. Гистопатология заражения Trichiurus savala Cuvier Caligus uruguayenses Thomsen (Copepoda: Caligidae). Fisch und Umwelt, 10: 147-152
Raynard RS, Bricknell IR, Billingsley PF, Nisbet AJ, Vigneau A, Sommerville C, 2002. Разработка вакцин против морских вшей. Pest Management Science, 58 (6): 569-575
Reilly P, Mulcahy MF, 1993. Гуморальный антительный ответ у атлантического лосося (Salmo salar L.) иммунизируют экстрактами эктопаразитов калигидных веслоногих ракообразных, Caligus elongatus (Nordmann, 1832) и Lepeophtheirus salmonis (Kroyer, 1838). Иммунология рыб и моллюсков, 3 (1): 59-70
Revie C, Gettinby G, Treasurer JM, Wallace C., 2003. Определение эпидемиологических факторов, влияющих на численность морских вшей Lepeophtheirus salmonis на шотландских лососевых фермах с использованием общих линейных моделей. Болезни водных организмов, 57: 85-95
Revie CW, Gettinby G, Treasurer JW, Rae GH, 2002.Эпидемиология морских вшей Caligus elongatus Nordmann в морской аквакультуре атлантического лосося Salmo salar L. в Шотландии. Journal of Fish Diseases, 25 (7): 391-399
Ritchie G, Mordue AJ, Pike AW, Rae GH, 1993. Репродуктивная продукция взрослых самок Lepeophtheirus salmonis в зависимости от сезонной изменчивости температуры и светового периода. В: Boxshall GA, DeFaye D, eds. Возбудители диких и выращиваемых рыб: морские вши. Нью-Йорк, США: Эллис Хорвуд, 153-165
Roth M, Richards RH, Dobson DP, Rae GH, 1996.Полевые испытания эффективности фосфорорганического соединения азаметифоса для борьбы с заражением морских вшей (Copepoda: Caligidae) выращиваемого атлантического лосося (Salmo salar). Aquaculture, 140 (3): 217-239
Roth M, Richards, RH, Sommerville C, 1993. Современные методы химиотерапевтического контроля заражения морскими вшами в аквакультуре: обзор. Journal of Fish Diseases, 16: 1-26
Roubal FR, 1981. Таксономия и специфичность участков многоклеточных эктопаразитов черного леща Acanthopagrus australis (Gunther) в северной части Нового Южного Уэльса.Австралийский зоологический журнал, дополнительная серия, № 84: 100 стр.
Roubal FR, 1990. Сезонные изменения эктопаразитарной инфекции молоди желтого леща Acanthopagrus australis (Gunther) (Pisces: Sparidae) из небольшого устья в северной части Нью-Йорка. Южный Уэльс. Австралийский журнал морских и пресноводных исследований, 41: 411-427
Roubal FR, 1994. Гистопатология, вызванная Caligus epidemicus Hewitt (Copepoda: Caligidae) у содержащихся в неволе Acanthopagrus australis (Günther) (Pisces: Sparidae).Journal of Fish Diseases, 17 (6): 631-640
Rough K, 2000. Иллюстрированное руководство по паразитам южного синего тунца, Thunnus maccoyii. Канберра, Австралия: Ассоциация владельцев лодок для тунца в Южной Австралии
Ruangpan L, Kabata Z, 1984. Беспозвоночный хозяин для Caligus (Copepoda, Caligidae)? Crustaceana, 47: 219-220
Russell FS, 1933. О встречаемости молодых стадий Caligidae на пелагической молоди рыб в районе Плимута. Журнал Морской биологической ассоциации, Великобритания, 18: 551-553
Shotter RA, 1973.Сравнение паразитарной фауны молоди путассу Odontogadus merlangus (L.) (Gadidae) с берега и с берега острова Мэн. Journal of Fish Biology, 5 (2): 185-195
Stone J, Sutherland IH, Sommerville C, Richards RH, Endris RG, 2000. Продолжительность эффективности после перорального лечения бензоатом эмамектина против заражения морских вшей, Lepeophtheirus salmonis (Крайер), в Атлантическом лососе Salmo salar L. Journal of Fish Diseases, 23 (3): 185-192
Thomassen JM, 1993.Перекись водорода как дезинфицирующее средство для атлантического лосося. В: Boxshall GA, DeFaye D, eds. Возбудители диких и выращиваемых рыб: морские вши. Нью-Йорк, США: Эллис Хорвуд, 290-295
Казначей JW, 1993. Борьба с морскими вшами (Caligidae) и губанами (Labridae) на фермах атлантического лосося (Salmo salar L.). В: Boxshall GA, DeFaye D, eds. Возбудители диких и выращиваемых рыб: морские вши. Нью-Йорк, США: Ellis Horwood, 335-345
Treasurer JW, Wadsworth S, Grant A, 2000. Устойчивость морских вшей Lepeophtheirus salmonis (Kryer) к перекиси водорода у выращиваемых на фермах атлантического лосося Salmo salar L.Aquaculture Research, 31 (11): 855-860
Tucker CS, Norman R, Shinn AP, Bron JE, Sommerville C, Wootten R, 2002. Модель временной задержки для одной когорты жизненного цикла лососевой вши Lepeophtheirus salmonis на атлантический лосось Salmo salar. Gyobyo Kenkyu = Fish Pathology, 37 (3): 107-118
Tully O, 1989. Последовательность поколений и рост веслоногих рачков Caligus elongatus и Lepeophtheirus salmonis, паразитирующих на выращиваемых на фермах смолтах атлантического лосося (Salmo salar L.). Журнал Морской биологической ассоциации Соединенного Королевства, 69 (2): 279-287
Tully O, Whelan KF, 1992.Воздействие морских вшей (Lepeophtheirus salmonis) на морскую форель (Salmo trutta L.) вдоль западного побережья Ирландии, 1989–1991. В кн .: Патологические состояния диких лососевых. Морская лаборатория SOAFD (аннотация)
Urawa S, 1998. Исследование Lepeophtheirus salmonis (Copepoda, Caligidae) на выращиваемом в морской воде кижуча (Oncorhynchus kisutch) и радужной форели (O. mykiss) в Японии. Бюллетень Национального центра ресурсов лосося, 1: 35-38
Urawa S, Kato T, 1991. Тяжелые инфекции Caligus orientalis (Copepoda: Caligidae) у радужной форели Oncorhynchus mykiss, содержащейся в клетках, в солоноватой воде.Патология рыб, 26: 161-162
Урава С., Мурога К., Идзава К., 1979. Caligus orientalis Gussev (Copepoda) паразитирует на акаме (Liza akame). Fish Pathology, 13 (3): 139-146
Wagner GN, McKinley RS, 2004. Анемия и способность плавать лососем: потенциальные эффекты сублетальной инфекции морских вшей. Journal of Fish Biology, 64 (4): 1027-1038
Wagner GN, McKinley RS, Bjrn PA, Finstad B, 2003. Физиологическое влияние морских вшей на плавание атлантического лосося. Журнал биологии рыб, 62 (5): 1000-1009
White HC, 1940.«Морские вши» (Lepeophtheirus) и гибель лосося. Canadian Journal of Fisheries and Aquatic Sciences, 5: 172-175
Wilson CB, 1905. Привычки и история жизни паразитических веслоногих ракообразных. Биологический бюллетень морской биологической лаборатории, 8: 236-237
Wootten R, Smith JW, Needham EA, 1982. Аспекты биологии паразитических копепод Lepeophtheirus salmonis и Caligus elongatus на выращиваемых лососевых и их лечение. Труды Королевского общества Эдинбурга, B, 81 (3): 185-197
Zeddam JL, Berrebi P, Renaud F, Raibaut A, Gabrion C, 1988.Характеристика двух видов Lepeophtheirus (Copepoda, Caligidae) из камбал. Описание Lepeophtheirus europaensis sp. ноя Паразитология, 96 (1): 129-144
Перейти к основному содержанию ПоискПоиск
- Где угодно
Поиск Поиск
Расширенный поиск- Войти | регистр
- Подписка / продление
- Учреждения
- Индивидуальные подписки
- Индивидуальные продления
- Библиотекари
- платежи и полные платежи Чикагский пакет
- Полный охват и охват содержимого
- Файлы KBART и RSS-каналы
- Разрешения и перепечатки
- Инициатива развивающихся стран Чикаго
- Даты отправки и претензии
- Часто задаваемые вопросы библиотекарей
- Агенты, 0
- тарифы, заказы
- и платежи
- Полный пакет Chicago
- Полный охват и содержание
- Даты отправки и претензии
- Часто задаваемые вопросы агента
- О нас
- Публикуйте у нас
- Публикация новых журналов tners
- Подпишитесь на уведомления eTOC
- Пресс-релизы
- Медиа
- Издательство Чикагского университета
- Распределительный центр в Чикаго
- Чикагский университет
- Положения и условия
- Заявление об издательской этике
- Уведомление о конфиденциальности
- Доступность Chicago Journals
- Доступность вузов
- Следуйте за нами на facebook
- Следуйте за нами в Twitter
- Свяжитесь с нами
- Запросы СМИ и рекламы
- Открытый доступ в Чикаго
- Следуйте за нами на facebook
- Следуйте за нами в Twitter
